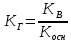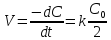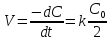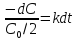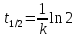|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №1
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №2
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №3
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №4
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №5
А) KOH (р) + HCl (р) = Б) CaO (оксид) + HNO3 (р) = В) Mg(OH)2 (н) + H3PO4 (р) = Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №6 1. Чистые вещества и смеси. Виды смесей, их значение. Вычислить массовые доли компонентов веществ в смеси (по выбору учителя). 2. Опыт: проведение реакций, подтверждающих характерные химические свойства кислот. Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №7
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №8
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №9
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №10
А) Al2(SO4)3 (р) + BaCl2 (р) = Б) Fe(OH)3 (н) + H3PO4 (р) = В) K2S + HCl = Преподаватель: Слюсарь К.С. . |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №11
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №12
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №13
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №14
А) Na2CO3 + HNO3 = Б) K2CO3 + H2SO4 = В) FeCl3 + NaOH = Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №15
А) HCl + MnO2 Б) H2S + KMnO4 + H2SO4 Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №16
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет № 17
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №18
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №19
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №20
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №21
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №22
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №23
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №24
Преподаватель: Слюсарь К.С. |
|
Департамент образования и науки Кемеровской области ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания» Экзамен по учебной дисциплине «Химия» Билет №25
Преподаватель: Слюсарь К.С. |
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г. зам.
директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель ____________ «__»
____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
Дисциплина: Химия
Семестр: 2
1. Периодический закон и периодическая
система химических элементов Д. И. Менделеева на основе представлений о
строении атомов. Значение периодического закона для развития науки.
2. Предельные углеводороды, общая формула
гомологов данного ряда. Химические свойства метана.
Практическое задание: Написание структурных формул возможных изомеров для
предложенной молекулярной формулы. Номенклатура ИЮПАК.
_______________________________________________________________________________________________________________
|
Областное государственное бюджетное профессиональное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2 Дисциплина: 1. Строение атомов химических элементов и закономерности в изменении 2. Непредельные углеводороды ряда этилена, общая формула и химическое Практическое задание: Нахождение молекулярной формулы углеводорода |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3 Дисциплина: Химия 1. Виды химической связи в неорганических и органических соединениях: 2. Циклопарафины, их строение, свойства, нахождение в природе, Практическое задание: Вычисление массы по известному количеству ______________________________________________________________________________________________________________ |
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г. зам.
директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель
____________
«__» ____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
Дисциплина:
Химия Семестр:
2
1. Классификация химических реакций в
неорганической и органической химии.
2.Диеновые углеводороды, их химическое
строение, свойства, получение и практическое значение. Натуральный и
синтетические каучуки.
Практическое задание: Вычисление массы по известному количеству
вещества одного из исходных или получающихся в реакции продуктов.
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______ г. зам.
директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель ____________ «__»
____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
Дисциплина:
Химия Семестр:
2
1. Обратимость реакций.
Химическое равновесие и способы его смещения: изменение концентрации
реагирующих веществ, температуры, давления.
2.Ацетилен – представитель углеводородов с тройной связью в молекуле.
Химические свойства, получение и применение ацетилена.
Практическое задание: Вычисление объема газа, необходимого для
реакции с определенным объемом другого газа.
______________________________________________________________________________________________________________
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6 Дисциплина: 1. Скорость химических 2. Ароматические углеводороды. Бензол, структурная формула, свойства Практическое задание: Нахождение молекулярной формулы углеводорода |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 7 Дисциплина: 1. Основные положения 2. Реакции ионного обмена. Условия их необратимости. Практическое задание: Вычисление массы одного из исходных |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 8 Дисциплина: 1. Изомерия 2. Классификация неорганических соединений. Практическое задание: Нахождение молекулярной формулы газообразного |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9 Дисциплина: 1. Неметаллы, их положение в периодической системе химических 2. Предельные одноатомные спирты, их строение, физические и Практическое задание: Нахождение молекулярной формулы органического |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10 Дисциплина: Химия 1. Металлы, их положение в периодической системе химических элементов Д. 2. Природные источники углеводородов: нефть, природный газ и их Практическое задание: Написание структурных формул возможных |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 11 Дисциплина: 1. Аллотропия 2. Фенол, его химическое строение, свойства, получение и применение. Практическое задание: Вычисление массы исходного вещества, если |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 12 Дисциплина: 1. Дисперсные системы. Классификация 2. Альдегиды, их химическое строение и свойства. Получение, Практическое задание: Нахождение молекулярной формулы вещества по его |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 16 Дисциплина: 1. Кислоты, их классификация и свойства на 2.Глюкоза – представитель моносахаридов, химическое строение, Практическое задание: Вычисление массы продукта реакции, если для его |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 17 Дисциплина: 1. Соли, их состав и 2. Крахмал. Нахождение в природе, практическое значение, гидролиз Практическое задание: Нахождение молекулярной формулы газообразного |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ____________ «__» ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 18 Дисциплина: 1.Химическая и 2.Аминокислоты, их строение и химические свойства: взаимодействие с Практическое задание: Вычисление объема полученного газа, если |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 13 Дисциплина: 1.Теория 2. Предельные одноосновные карбоновые кислоты, их строение и свойства Практическое задание: Нахождение молекулярной формулы газообразного |
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г.
зам. директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель
____________
«__» ____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 14
Дисциплина:
Химия Семестр:
2
1. Гидролиз солей, его типы.
2.Жиры как сложные эфиры глицерина и карбоновых кислот, их состав и
свойства. Жиры в природе. Понятие о СМС. Защита природы от загрязнения СМС.
Практическое задание: Вычисление количества вещества продукта реакции
по массе исходного вещества, содержащего примеси.
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 15 Дисциплина: 1. Окислительно- 2. Глицерин – многоатомный спирт; состав молекул, физические и Практическое задание: Нахождение молекулярной формулы вещества по его |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ____________ «__» ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 19 Дисциплина: 1. Основания, их 2.Анилин – представитель аминов; химическое строение и свойства; Практическое задание: Вычисление массы или объема продукта реакции, |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 20 Дисциплина: Химия 1. Элементы IА-группы. Щелочные металлы. Общая характеристика щелочных 2.Взаимосвязь между важнейшими классами органических соединений. Практическое задание: Вычисление теплового эффекта реакции по |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ____________ «__» ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 21 Дисциплина: 1. Элементы 2.Белки как биополимеры. Свойства и биологические Практическое задание: Расчет объемной доли выхода продукта реакции в |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ____________ «__» ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 22 Дисциплина: 1. 2.Взаимное влияние атомов в молекулах органических Практическое задание: Вычисление массы и объема |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 23 Дисциплина: 1. Алюминий. Характеристика алюминия на основании положения в Периодической 2.Получение спиртов из непредельных углеводородов. Промышленный Практическое задание: Расчет количества вещества |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 24 Дисциплина: 1.Общая характеристика элементов VI 2.Общая характеристика высокомолекулярных соединений: состав, Практическое задание: Вычисление массы исходного вещества, если |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 25 Дисциплина: 1.Общие 2.Целлюлоза, состав молекул, физические и химические Практическое задание: Расчет массы одного из |
|
Областное государственное бюджетное «Старомайнский технологический техникум» Рассмотрено методической комиссией «___»_____________ 20______ Протокол № ______ Учебная Председатель ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 26 Дисциплина: 1. Общая 2. Генная инженерия и биотехнология. Трансгенные формы растений и Практическое задание: Нахождение молекулярной |
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г.
зам. директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель
____________
«__» ____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 27
Дисциплина:
Химия Семестр:
2
1. Общая характеристика d
–элементов. Медь, цинк, как простые вещества, их физические и химические
свойства. Соединения d – элементов, их значение и применение.
2. Природный и синтетический каучук, их получение, свойства и
применение.
Практическое задание: Задание на идентификацию веществ.
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г.
зам. директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель ____________
«__» ____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 28
Дисциплина:
Химия Семестр:
2
1. Железо
– представитель металлов побочных подгрупп. Особенности строения его атома,
физические и химические свойства железа. Природные соединения железа.
Применение железа и его сплавов.
2. Ферменты. Понятие о
ферментах как о биологических катализаторах белковой природы. Классификация
ферментов. Особенности строения и свойств ферментов: селективность и
эффективность. Зависимость активности ферментов от температуры и рН среды.
Значение ферментов в биологии и применение в промышленности.
Практическое задание: Расчет количества вещества
продукта реакции по данным об исходных веществах, одно из которых дано в
избытке.
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г.
зам. директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель
____________
«__» ____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 29
Дисциплина:
Химия Семестр:
2
1. Галогены. Общая характеристика галогенов на основании
их положения в Периодической системе элементов Д. И. Менделеева и строения
атомов. Важнейшие соединения галогенов, их свойства, значение и применение.
Галогены в природе. Биологическая роль галогенов.
2. Витамины. Понятие о витаминах. Их классификация и
обозначение. Норма потребления витаминов. Водорастворимые (на примере
витаминов С, группы В и Р) и жирорастворимые (на примере витаминов А, D и Е).
Авитаминозы, гипервитаминозы и гиповитаминозы, их профилактика.
Практическое задание: Вычисление массы исходного вещества, если
известен практический выход продукта и указана массовая доля его в процентах
от теоретически возможного выхода.
Областное государственное бюджетное
профессиональное образовательное учреждение
«Старомайнский технологический техникум»
Рассмотрено методической комиссией
Специальность 38.02.05 Утверждаю
«___»_____________ 20______
г.
зам. директора по УР
Протокол № ______ Учебная
группа 11 _________________
Председатель
____________
«__» ____________ 20___ г.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 30
Дисциплина:
Химия Семестр:
2
1. Амфотерные
органические и неорганические соединения. Амфотерные
основания в свете протолитической теории. Амфотерность оксидов и гидроксидов
переходных металлов: взаимодействие с кислотами и щелочами
2. Гормоны. Понятие о
гормонах как биологически активных веществах. Классификация гормонов:
стероиды, производные аминокислот, полипептидные и белковые гормоны.
Отдельные представители: эстрадиол, тестостерон, инсулин, адреналин.
Практическое задание: Нахождение молекулярной
формулы углеводорода по массовой доле элементов и относительной плотности
паров углеводорода по другому газу.
Билет №1 (3)
Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.
|
Дано: |
Решение: |
|
Dвозд(CxHy) = 2 ω(C) = 82,75% ω(H) = 17,25% |
Mвозд = 29 г/моль M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г ν(C) : ν(H) = M(C4H10) = 48 + 10 = 58 г/моль |
|
CxHy – ? |
Ответ: С4Н10 |
Билет №2 (3)
Осуществить превращения:
Натрий → гидроксид натрия → карбонат натрия → хлорид натрия → нитрат натрия
Na NaOH
Na2CO3
NaCl
NaNO3
0 +1 -2 +1 -2 +1 0
- 2Na + 2H2O → 2NaOH + H2↑
в-ль ок-ль
Na0 – 1e— → Na+1 | 2
2H+1 + 2e— → H2 | 1
- 2NaOH + CO2 → Na2CO3 + H2O
2Na+ + 2OH– + CO2 → 2Na+ + CO32– + H2O
2OH– + CO2 → CO32– + H2O
- Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na+ + CO32– + 2H+ + 2Cl– → 2Na+ + 2Cl– + CO2↑ + H2O
CO32– + 2H+ → CO2↑ + H2O
- NaCl + AgNO3 → NaNO3 + AgCl↓
Na+ + Cl– + Ag+ + NO3– → Na+ + NO3– + AgCl↓
Cl– + Ag+ → AgCl↓
Билет №3 (3)
Какой объём хлора прореагирует с натрием массой 34,5г. Определить массу хлорида натрия.
|
Дано: |
Решение: |
|
m(Na) = 34,5г |
34,5 г x л y л 2Na + Cl2 → 2NaCl 2 моль 1 моль 2 моль 46 г 22,4 л 117 г m = M ∙ ν V = Vm ∙ ν M(Na) = 23 г/моль M(NaCl) = 58,5 г/моль m(Na) = 23 г/моль ∙ 2 моль = 46 г m(NaCl) = 58,5 г/моль ∙ 2 моль = 117 г Vm = 22,4 л/моль V(Cl2) = 22,4 л/моль ∙ 1 моль = 22,4 л |
|
V(Cl2) – ? m(NaCl) – ? |
Ответ: V(Cl2) = 16,8 л; m(NaCl) = 87,8 г |
Билет №4 (3)
Осуществить превращения:
Магний → хлорид магния → гидроксид магния → оксид магния → сульфат магния
Mg MgCl2
Mg(OH)2
MgO
MgSO4
0 +1 -1 +2 -1 0
- Mg + 2HCl
MgCl2 + H2↑
в-ль ок-ль
Mg0 – 2e— → Mg+2 | 1
2H+ + 2e— → H20 | 1
- MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Mg2+ + 2Cl– + 2Na+ + 2OH– → Mg(OH)2↓ + 2Na+ + 2Cl–
Mg2+ + 2OH– → Mg(OH)2↓
- Mg(OH)2
MgO + H2O
- MgO + H2SO4 → MgSO4 + H2O
MgO + 2H+ + SO42– → Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
Билет №5 (3)
Какой объём хлора прореагирует с железом массой 400г, если массовая доля примесей в нём 20%?
|
Дано: |
Решение: |
|
mобр(Fe) = 400 г ωприм = 20% |
320 г x л 2Fe + 3Cl2 → 2FeCl3 2 моль 3 моль 112 г 67,2 л mприм = 0,2 ∙ 400 г = 80 г m(Fe) = mобр – mприм = 400 г – 80 г = 320 г M(Fe) = 56 г/моль; m(Fe) = 56 г/моль ∙ 2 моль = 112 г Vm = 22,4 л/моль V(Cl2) = Vm ∙ ν = 22,4 л/моль ∙ 3 моль = 67,2 л |
|
V(Cl2) – ? |
Ответ: V(Cl2) = 192 л |
Билет №6 (3)
Осуществить превращения:
Медь → хлорид меди (II) → гидроксид меди (II) → оксид меди (II) → медь
Cu CuCl2
Cu(OH)2
CuO
Cu
0 0 +2 –1
- Cu + Cl2 → CuCl2
в-ль ок-ль
Cu0 – 2e— → Cu+2 | 1
Cl2 + 2e— → 2Cl– | 1
- CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + 2Cl–
Cu2+ + 2OH– → Cu(OH)2↓
- Cu(OH)2
CuO + H2O
+2 –2 0 t 0 +1 –2
- CuO + H2
Cu + H2O
ок-ль в-ль
Cu+2 + 2e— → Cu0 | 1
H20 – 2e— → 2H+1 | 1
Билет №7 (3)
При прокаливании 300 г известняка, содержащего 10% примесей, получено 75 г негашеной извести. Найти массовую долю выхода продукта реакции от теоретически возможного.
|
Дано: |
Решение: |
|
mобр(CaCO3) = 300г ωприм = 10% mпракт(CaO) = 75г |
270 г x г CaCO3 1 моль 1 моль 100 г 56 г mприм = 300 г ∙ 0,1 = 30 г m(CaCO3) = 300 г – 30 г = 270 г
= 49,6% |
|
η(CaO) – ? |
Ответ: η(CaO) = 49,6 % |
Билет №8 (3)
Какова масса соли, получившейся в результате взаимодействия 100 г соляной кислоты с 14 г оксида кальция?
|
Дано: |
Решение: |
|
m(HCl) = 100 г m(CaO) = 14 г |
0,25 моль х моль CaO + 2HCl → CaCl2 + H2O 1 моль 2 моль 1 моль m = M ∙ ν M(CaCl2) = 40 + 71 = 111 г/моль m(CaCl2) = 111 г/моль ∙ 0,25 моль = 27,75 г ≈ 27,8 г |
|
m(CaCl2) – ? |
Ответ: m(CaCl2) = 27,8 г |
Билет №9 (3)
Какой объём ацетилена необходимо сжечь для получения 24 л оксида углерода (IV)?
|
Дано: |
Решение: |
|
V(CO2) = 24 л |
x л 24 л 2C2H2 + 5O2 → 4CO2 + 2H2O 2V 4V |
|
V(C2H2) – ? |
Ответ: V(C2H2) = 12 л |
Билет №10 (3)
Осуществить превращения:
Гидроксид меди (II) → сульфат меди (II) → медь →
→ оксид меди (II) → нитрат меди (II)
CuO CuSO4
Cu
CuO
Cu(NO3)2
- CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ + SO42– → Cu2+ + SO42– + H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
- CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
- 2Cu + O2 → 2CuO
в-ль ок-ль
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O–2 | 1
- CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ + 2NO3– → Cu2+ + 2NO3– + H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
|
Дано: |
Решение: |
|
mобр(CaC2) = 100 г ωприм = 15% |
85 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
|
V(C2H2) – ? |
Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe FeCl2
Fe(OH)2
FeSO4
FeCl2
0 +1 –1 +2 –1 0
- Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
- FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ + 2Cl– + 2K+ + 2OH– → Fe(OH)2↓ + 2K+ + 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
- Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2H+ + SO42– → Fe2+ + SO42– + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
- FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+ + SO42– + Ba2+ + 2Cl– → Fe2+ + 2Cl– + BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
|
Дано: |
Решение: |
|
m(CH3COOH) = 120 г m(NaOH) = 60 г |
1,5 моль х моль CH3COOH + NaOH → CH3COONa + H2O 1 моль 1 моль 1 моль
M(CH3COOH) = 60 г/моль M(NaOH) = 40 г/моль
m = M ∙ ν M(CH3COONa) = 82 г/моль m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
|
m(CH3COONa) – ? |
Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
|
Дано: |
Решение: |
|
m(CaC2) = 38,4 г |
38,4 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
|
V(C2H2) – ? |
Ответ: V(C2H2) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
|
Дано: |
Решение: |
|
m (HCl) = 73 г ω(NaOH) = 4% |
2 моль x моль HCl + NaOH → NaCl + H2O 1 моль 1 моль m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г |
|
mр-ра(NaOH) – ? |
Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу вещества, содержащего 80% углерода и 20% водорода, если плотность по водороду равна 15.
|
Дано: |
Решение: |
|
DH2(CxHy) = 15 ω(C) = 80% ω(H) = 20% |
M(H2) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г ν(C) : ν(H) = M(C2H6) = 24 + 6 = 30 г/моль |
|
CxHy – ? |
Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4 CH3Cl
C2H6
C2H4
C2H5OH
- CH4 + Cl2
CH3Cl + HCl
- 2CH3Cl + 2Na
CH3–CH3 + 2NaCl
- CH3–CH3
CH2=CH2 + H2
- CH2=CH2 + H2O
CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2 CH3–CH3
CH3CH2Cl
CH3CH2OH
CH2=CH2
- CH2=CH2 + H2
CH3–CH3
- CH3–CH3 + Cl2
CH3CH2Cl + HCl
- CH3CH2Cl + KOH(водный р-р) → CH3CH2OH + KCl
- CH3CH2OH
CH2=CH2 + H2O
19. Оксид кальция, полученный при прокаливании 20г карбоната кальция, обработали водой. Вычислите массу полученного продукта.
Дано: 20 г t X г
CaCO3 → CaO + CO2
m(CaCO3) = 20г 1 моль 1 моль
100г 56г
m(Ca(OH)2) — ?
x = 20 г * 56 г = 11,2г
100г
11,2г Yг
CaO + H2O → Ca(OH)2
1 моль 1 моль
56г 84г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
20. Относительная плотность паров органического соединения по водороду равна 71. При сжигании 2,84г этого вещества образуется 4,48л углекислого газа и 3,96г воды. Выведите молекулярную формулу этого соединения.
Дано:
DH2(CxHy)= 71
m(CxHy)=2,84г
m(СO2)=4,48 л
m(H2O)=3,96 г
CxHy — ?
М(CxHy) = DH2(CxHy) * М(H2) = 71*2г/моль=142г/моль
Х2 4,48л
C CO2 x = 12г * 4,48л = 2,4г
12г 22,4л 22,4л
Y2 3,96г
2Н Н2О y = 2г * 36г =0,44г
2г 18г 18г
х + у = m(С) + m(H) = 2,4г + 0,44г = 2,84г
V(С) :V(H) = 2,4г : 0,44г = 0,2 : 0,44= 10 :22
12г/моль 1г/моль
C10H22-простейшая формула
М(C10H22)=120+22=142 г/моль
Ответ: C10H22
Билет
№1. Химическая система. Вещество и
химические превращения. Химический
элемент. Простое и сложное вещество.
Основные свойства химических систем.
Химическая двойственность. Типы
химических реакций.
Химическая
система
– совокупность микро и макро количеств
веществ, способных воздействием
внешних факторов (условий) к превращениям
с образованием новых химических
соединений.
Вещество
— вид материи, обладающее массой покоя
и состоящий главным образом из
элементарных частиц (электронов,
протонов, нейтронов).
Любое
вещество состоит из структурных единиц
– атомов, молекул, ионов.
Атом
– наименьшая частица химического
элемента, носитель его свойств. Является
самой простой электро нейтральной
химической микросистемой, подчиняющейся
законам квантовой механики.
Химические
превращения
– такие превращения, при которых
происходят изменения только во внешних
электронных слоях атомов, не затрагивая
внутренние слои и ядра.
Основные
признаки химических привращений:
-
Выделение
газа. -
Образование
осадка. -
Выделение
или поглащение теплоты Q. -
Изменение
цвета как результат изменения
электронного стороения или степени
окисления элементов в молекулах.
Химический
элемент
– совокупность атомов с одинаковым
зарядом ядра (пример: 63Сu
и 65Сu
– изотопы).
Молекула
– наименьшая частица химического
вещества, способная к самостоятельному
существованию как единая динамическая
система, состоящая из положительно
заряженных ядер и отрицательно
заряженных электронов (пример:
2Cl—2e->Cl2).
Ионы
– частицы реального вещества (одно
или много атомные), несущие на себе
электрический заряд (пример: простые
– H+, Na+, Сu2+;
сложные – NH4+,
SO42-).
Простые
вещества
– молекулы состоят из атомов одного
и того же элемента (пример: металлы и
неметаллы атомного строения – Cu, Ag,
C, Si; неметаллы молекулярного строения
– J2,
Br2,
O2).
Сложные
вещества
– молекулы состоят из атомов разных
химических элементов (примеры: LiH,
NaF).
Свойство
веществ проявлять различные свойства
в зависимости от условий среды
называется химической
двойственностью
(пример: амфотерность Al(OH)3)
Типы
химических реакций:
Разложения
– реакции при которых из одного
вещества происходит образование
нескольких веществ (пример: 2HgO=2Hg+O2).
Cоединения
– оброазование из нескольких веществ
одного (пример: H2+I2=2HI).
Обмена
– реагирующие вещества обмениваются
составными частями (пример:
CaO+2HCl=CaCl2+H2O).
Частным случаем является реакции
нейтрализации – взамодействие кислот
с основаниями.
Замещения
– простое вещество вытесняет из
простое из сложного (пример:
Fe+2HCl=FeCl2+H2).
К
особому типу относятся
окислительно-восстановительные
реакции,
сочетающие в себе все или отдельные
вышеперечисленные типы реакций.
Билет
№2. Электронное строение атома,
квантовые числа, типы орбиталей.
Порядок заполнения энергетических
уровней и подуровней (минимум энергии,
принцип Паули, правило Хунда, правило
Клечковского). Особенности формирования
многоэлектронных подуровней (d
и f
подуровней). Валентность.
Атом
– наименьшая частица химического
элемента, носитель его свойств, состоит
из положительно заряженного ядра и
электронов. Является самой простой
электро нейтральной химической
микросистемой, подчиняющейся законам
квантовой механики.
Для
электрона в атоме справедлив принцип
двойственности:
электрон является одновременно и
материальной частицей малой массы и
электромагнитной волной.
Принцип
неопределнности Гейзенберга:
В каждый конкретный момент времени
нельзя с одинаковой точностью определить
место нахождения электронов (координаты
x,y,z) и его скорость (или импульс).
-
Движение
электорона в атоме может быть
представлено в виде электронного
облака.
Область
электронного облака, в которой электрон
проводит более 95% времени называется
электронной орбиталью (Э.О.). Больший
размер орбитали характеризует большую
энергию электрона. Орбитали близкого
размера образуют энергетические
уровни, которые состоят из подуровней.
Для
описания состояния электрона в атоме
используются 4 квантовых числа
(n,l,m,s).
Первые три соответствуют трем степеням
свободы электрона в трехмерном
пространстве, а четвертое соответсвует
вероятности вращения электрона вокруг
воображаемой собственной оси. Квантовые
числа:
“n”
– главное квантовое число. Характеризует
уровень энергии электрона в поле атома
(удаленность от ядра). Математическая
зависимость энергии связи с ядром:
Ea=-13,6/n2 Эв, n=1,2,… Для реальных элементов
n=1,…,7. n=номеру периода.
“l”
– орбитальное квантовое число.
Характеризует тип подуровня (форма
электронного облака). l=0,1,2,…,(n-1).
Обозначается буквами. При этом l=0
соответствует s, 1-p, 2-d, 3-f, 4-q, 5-h.
(s,p,d,f,q,h
— это
типы орбиталей)
“m”
– магнитное квантовое число.
Характеризует пространственное
расположение орбитали. m=± 0, ± 1, ± 2,…,
± l. Cумма орбиталей на подуровне: е
=2l+1.
“s”
– спиновое квантовое число. Характеризует
вероятность вращения электрона вокруг
своей оси в двух противоположенных
направлениях. s=± 1/2. “+” – по часовой
стрелке, “-“ – против часовой стрелке.
Вращение сообщает электрону собственный
магнитный момент, который называется
спином электрона.
Порядок
заполнения энергетических уровней и
подуровней:
-
Принцип
Паули (запрет):
у атомов, имеющих больше одного
электрна не может быть двух электронов
с одинаковыми значениями всех четырех
квантовых чисел. Или так: на одной
орбитали могут находится только два
электрона, причем с противоположенными
спинами. -
Принцип
минимума энергии:
последовательное заполенние электронов
в атоме должно отвечать как минимому
энергии самого электрона, так и
минимому энерги атома в целом. Или
так: минимум энергии соответствует
максимому устойчивости. Заполение
идет в соответсвии с уравнением
энергии орбитали: ns<(n-1)d» (n-2)f<np. На
внешнем уровне не может быть более 8
электронов. -
Правило
Клечковского:
сначала заполняются те подуровни,
сумма n+l которых наименьшая. Если для
двух подуровней сумма n+l равна, то
сначала заполняется подуровень с
меньшим n. -
Правило
Хунда:
в основном (невозбужденном) состоянии
атома на подуровнях np, nd и nf всегда
имеется максимальное количество
неспаренных электронов (максимальный
неспаренный спин).
Валентность
– способность образовывать химические
связи.
Основное
состояние
– состояние с минимальной энергией,
т.е электроны находятся ближе к ядру.
Возбужденное
состояние
– состояние, при котором все или часть
электронов в атоме распарены и находятся
на подуровне с большей энергией, т.е
дальше от ядра.
Максимальная
валентность
наблюд. в возбужденном сост. и как
правило совпадает с ном. группы, в
которой находится элемент.
Билет
№3. Периодическая система Д.И.Менделеева
(ПСЭ). Взаимосвязь химических свойств
простых веществ с электронным строением
атомов. Характер зависимостей радиусов
атомов, энергии ионизации, сродства
к электрону и электроотрицательности
в ПСЭ. Металлы и неметаллы.
-
Свойства
элементов и их соединений находятся
в периодической зависимости от заряда
ядра и порядкового номера элемента
в таблице, т.к. с ростом заряда и
порядкового номера периодически
возобновляются на более высоких
уровнях электронные конфигурации
внешних слоев.
Взаимосвязь
химических (физических) свойств с
местоположением элемента:
-
Орбитальный
радиус свободного атома R. R в периоде
слева направо уменьшается с увеличением
порядкового номера. Монотонное
уменьшение нарушается при переходе
от одного типа элемента к другому.
Монотонность нарушается: а) при
переходе от d к p — R(Zn)<R(Ga) б) при
стремлении к минимуму энергии –
R(Ni)<R(Cu). В периодах с уменьшением R
ослабляются металлические свойства
и нарастают неметаллические. В группах
сверху вниз R возрастает, т.к. растет
число электронных слоев – металлические
свойства усиливаются .
—
Энергия ионизации (Э.И.) –
энергия, необходимая для отрыва
электрона и удаления его от атома на
бесконечность. В периодах Э.И. возрастает,
но не равномерно. В главных подгруппах
уменьшается сверху вниз, т.к. радиус
увеличивается.
—
Энергия сродства к электрону
– энергия, выделяемая или поглощаемая,
при присоединении электрона к атому.
Свойства аналогичны Э.И.
—
Электроотрицательность (Э.О.)
– способность атома притягивать или
отталкивать электронные пары химической
связи. Если Э.О. > 1,5 – металл; 1,5<
Э.О.<2 – переходные свойства; Э.О.>2
– неметаллы. По Полингу абсолютная
Э.О. определяется как (Еион+Еср)/z. На
практике используется относительная.
Э.О. возрастает по периоду, в целом
имея сложную зависимость.
Билет
№4. Химическая связь. Метод валентных
связей. Основные виды (ковалентная,
ионная, донорно-акцепторная, водородная
и металлическая) и характеристики
(энергия, длина, направленность,
полярность и Поляризуемость) химической
связи. Взаимосвязь вида, характеристик
химической связи и электроотрицательности
элементов. Характеристики химической
связи, состав и строение молекул.
Степень окисления. Межмолекулярные
взаимодействия.
Химическая
связь
— это совокупность сил электростатического
притяжения и отталкивания, создающее
динамически устойчивую систему из
двух и более атомов. Основной принцип
образования молекул из атомов – это
стремление к минимальной энергии и к
максимальной устойчивости (пример:
H(г)+H(г)=H2(г) + 435 кДж/моль энергии).
Метод
валентных связей: теория
Гайтлера, Лондон 1940 г.
-
Объясняет
принцип образование валентных связей -
Объясняет
два типа ковалентных связей
Виды
химической связи:
-
Ковалентная
связь
– связь атомов за счет обществления
электронной пары с антипараллельными
спинами. Ковалентная
неполярная
связь возникает между неметаллами,
разность электроотрицательности
между которыми невелика: 0<Э.О.<0,4
(пример: PH3; Э.О.(P)=2,1; Э.О.(H)=2,2; D Э.О.=0,1).
Соответственно ковалентная
полярная
связь возникает между элементами с
большой электроотрицательностью:
0,4<Э.О.<2
(пример: HCl Э.О.(H)=2,2; Э.О.(Cl)=3,1; D Э.О.=0,9). -
Ионная
связь
– это связь обусловленая электростатическим
взаимодействием противоположно
заряженных ионов. Для ионной связи
Э.О.>2
(пример: NaCl Э.О.(Na)=0,9; Э.О.(Cl)=3,1; D Э.О.=2,2). -
Водородная
связь
– связь, обусловленная положительно
поляризованным водородом в молекуле
и электроотрицательным атомом другой
или той же молекулы. -
Металлическая
связь
– связь, обусловленная электростатическим
взаимодействием между обобществленными
делокализованными валентными
электронами и положительно заряженными
катионами в узлах кристаллической
решетки. -
Донорно-акцепторная
связь:
один из способов образования химической
ковалентной связи, осуществляется
за счёт пары электронов одного атома
(донора) и свободной (незаполненной)
орбитали другого (акцептора).
Основные
характеристики химической связи:
-
Энергия
химической связи (Exc)
– определяет прочность связи. Данная
энергия необходима для превращения
одного моля газообразного (молекулярного)
вещества в отдельные газообразные
атомы. Энергия ковалентной связи
имеет порядок 10-1000 кДж/моль. -
Длина
химической связи (Lxc)
– расстояние между ядрами химически
связанных атомов. Чем короче длина
химической связи, тем связь прочнее.
Длина химической связи имеет порядок
0,1-0,3 нм. -
Полярность
химической связи
– неравномерное распределение
электронной плотности между атомами
в молекуле из-за разной
электроотрицательности. В неполярных
молекулах центры тяжести положительных
и отрицательных зарядов совпадают.
Полярные молекулы являются диполями. -
Поляризуемость
– способность электронной плотности
становится полярной в результате
действия на молекулу внешнего
электрического поля – в частности
поля других молекул, вступающих в
реакцию. -
Направленность
– определенное направление химической
связи, которое возникает в результате
перекрывания электронных облаков.
Направленность определяется строением
молекулы.
Состав
молекул
сложных веществ выражается при помощи
химических формул.
Строение
молекул
(молекулярная структура), взаимное
расположение атомов в молекулах.
Степень
окисления
— (окислительное число), условный
показатель, характеризующий заряд
атома в соединениях.
Межмолекулярное
взаимодействие
— взаимодействие между электрически
нейтральными молекулами или атомами.
-
К
межмолекулярным взаимодействиям
относятся: ориентационные
– взаимодействие полярных молекул
друг с другом обусловленная наличием
постоянных дипольных моментов;
индукционные – взаимодействие
полярных молекул и неполярных с
индуцируемыми полями; дисперсионные
– взаимодействие неполярных молекул
друг с другом за счет возникновения
мгновенных дипольных моментов.
Билет
№5. Энергетика химических процессов.
Тепловой эффект и энтальпия реакции.
Законы термохимии. Энтальпия образования
химических соединений. Энтропия.
Энергия Гиббса, ее связь с направлением
химических процессов.
Энергетика
химических процессов
– часть химической термодинамики
(часть общей термодинамики).
Энергетическое
состояние химической реакции как
системы описывается с использованием
следующих характеристик:
U-внутренняя энергия, H-энтальпия,
S-энтропия, G-энергия Гиббса.
-
Теплота,
которую получает система, идет на
приращение внутренней энергии и
совершение работы: Q=U+A.
Если система не совершает никакой
работы, кроме работы расширения, то
Q=U+pV.
Величина H=U+pV
при p=const называется энтальпией
реакции.
Т.к. внутреннюю энергию тела измерить
невозможно (можно измерить только
изменение U),
то точно так же невозможно измерить
энтальпию тела – в расчетах используется
изменение энтальпии H.
Чем отрицательнее H
тем вещество более устойчивое и менее
реакционноспособное.
Стандартной
энтальпией образования
называется изобарный тепловой эффект
реакции получения одного моля сложного
вещества из простых веществ, взятых
в их наиболее устойчивой форме при
стандартных условиях (T=298К, p=1 атм., С=1
моль/л). Энтальпия образования простых
веществ в их устойчивом состоянии при
стандартных условиях принимается
равной 0.
Законы
термохимии:
-
Лавуазье-Лапласа:
тепловой эффект образования химических
соединений равен, но обратен по знаку
тепловому эффекту его разложения. -
Гесса:
тепловой эффект реакции при постоянном
давлении или объеме зависит только
от начального и конечного состояния
системы и не зависит от пути перехода.
Энтропия
– количественная мера беспорядка
системы. Имеет статистический смысл
и является характеристикой систем,
состоящих из достаточно большого, но
ограниченного числа частиц. Энтропия
выражается через термодинамическую
вероятность системы – числа
микросостояний, соответствующих
данному микросостоянию. Энтропия
зависит от: от числа частиц в системе,
от природы вещества, от агрегатного
состояния. Для химических реакций
изменение энтропии рассчитывается
по абсолютным значениям энтропии
компонентов. Для реакций, протекающих
в водном растворе, расчет производится
по краткой ионной формуле. Для
газообразных веществ знак S
определяется по изменению объема.
Если объем не изменяется, то знак
определить нельзя. В изолированных
системах возможны процессы, которые
идут с увеличением энтропии. Это
означает, что знак S
можно принять за критерий возможного
самопроизвольного протекании реакции
(только в изолированных системах!). В
общем случае в открытых системах
данный критерий применять нельзя.
-
Суммарное
влияние энергетических и энтропийных
факторов при постоянном давлении и
температуре отражает изменение
изотермического потенциала, который
называется изменением
свободной энергии Гиббса:
G=H-TS.
Свободной
энергией Гиббса называется энергия,
складываемая из энергий химических
связей.
Знак
G
есть критерий термодинамической
вероятности самопроизвольного
протекания процесса в данных условиях
(p,T=const). При данных условиях могут
самопроизвольно протекать только те
процессы G
для которых меньше 0. Из уравнения
видно, что можно определить направление
процесса при любой температуре, но
данный расчет приблизителен, т.к. не
учитывается температурная зависимость
энтальпии и энтропии. При низких
температурах протекают главным
образом экзотермические реакции. При
высоких температурах главную роль
играет энтропийный член уравнения,
что видно на примере того, что реакции
разложения сложных веществ на простые
в основном протекают при высокой
температуре.
Билет
№6. Химическое равновесие. Закон
действия масс. Константа равновесия.
Химическое равновесие в гетерогенных
системах. Произведение растворимости.
Гидролиз. Смещение равновесия
диссоциации воды в растворах
электролитов. Гидролиз по катиону и
аниону(изменение рН среды). Константа
и степень гидролиза. Принцип Ле Шателье.
Химическое
равновесие
– динамическое состояние системы,
при котором скорость прямой реакции
равна скорости обратной реакции, а
соотношение количеств исходных веществ
и продуктов не изменяется во времени.
Закон
действия масс
– состояние химического равновесия
не зависит от концентрации и давления
химической системы при постоянной
температуре, т.е. является постоянной
величиной.
Константа
равновесия:
Если в системе протекает реакция
νАА+νВB
νCC+νDD,
то
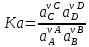
константа равновесия;
–
концентрационная константа равновесия;
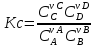
Термодинамическая константа равновесия
не зависит от состава системы, а
определяется лишь природой вещества
и температурой. В общем случае Ka≈Kp≈Kc,
но в предельно разбавл. растворах
данное соотношение может нарушаться.
Энергия Гиббса связана с константой
равновесия соотн-ем G=˗RTlnK.
-
Химические
реакции, протекающие на границе
раздела фаз, называются гетерогенными
химическими реакциями. -
При
равенстве скоростей прямой и обратной
реакции наступает химическое
равновесие в гетерогенной системе.
Примерами гетерогенных процессов
является восстановление оксидов
металлов водородом: МеО(к) + Н2
= Ме(к) + Н2О.
Как
и для любого равновесия, условием
гетерогенного химического равновесия
является равенство энергии Гиббса
нулю, ΔG
= 0
Произведение
растворимости (ПР)
— произведение концентрации ионов
малорастворимого электролита в его
насыщенном растворе при постоянной
температуре и давлении. Произведение
растворимости — величина постоянная.
Гидролиз
– взаимодействие солей с водой. В
результате протекания процесса
гидролиза соли в растворе появляется
избыток H+ и OH—,
сообщающий раствору кислотные или
основные свойства. Гидролизу не
подвергаются соли, образованные
сильным основанием и сильной кислотой
(например HCl). В результате гидролиза
соли, образованной слабой кислотой и
сильным основанием (гидролиз
по аниону)
появляется некоторое избыточное
количество гидроксид-ионов(ОН—),
в результате чего среда становится
основной. Гидролиз соли, образованной
сильной кислотой и слабым основанием
(гидролиз
по катиону)
приводит к появлению избытка протонов
т.е. (Н+),
в результате чего среда становится
кислой.
Константа
диссоциации:
-
Для
соли образованной слабой кислотой и
сильным основанием:
,
КВ=СН+СОН-=10-14
– ионное произведение воды. -
Для
соли образованной сильной кислотой
и слабым основанием:
-
Под
степенью
гидролиза
подразумевается отношение части
соли, подвергающейся гидролизу, к
общей концентрации её ионов в растворе.
Обозначается α: α = (Сгидр/Собщ)·100
%, где Сгидр
— число молей гидролизованной соли,
Собщ
— общее число молей растворённой
соли. Степень гидролиза соли тем выше,
чем слабее кислота или основание, её
образующие.
Принцип
Ле Шателье:
если на систему, находящуюся в равновесии
оказывают воздействие извне, то
равновесие смещается в сторону той
реакции (прямой или обратной), которая
ослабляет это воздействие.
Факторы,
оказывающее влияние на реакцию:
-
Изменение
концентрации.
Увеличении концентрации исходных
веществ вызывает увеличение скорости
и соответственно увеличение концентрации
продукта – происходит смещение
равновесия вправо. Через некоторое
время равновесие вновь устанавливается
и отношение концентраций продуктов
и исходных веществ остается неизменным. -
Изменение
температуры.
В экзотермической реакции повышение
температуры смещает равновесие влево,
т.е в сторону эндотермической реакции
и наоборот. В эндотермической реакции
повышение температуры смещает
равновесие вправо. -
Увеличение
давления.
Увеличение давления смещает равновесие
в сторону той реакции, которая
сопровождается уменьшением числа
молей газа.
Билет
№7. Химическая кинетика. Скорость
химической реакции и закон действия
масс для скорости. Порядок и молекулярность
реакции. Кинетическое уравнение
реакции первого порядка. Зависимость
скорости реакции от температуры.
Уравнение Аррениуса. Энергия активации.
Катализ.
Химическая
кинетика
изучает скорость и механизм протекания
химических процессов, а так же их
зависимость от различных факторов.
Скоростью
химических реакций
называется изменение концентрации
за единицу времени. Т.к. концентрация
непрерывно меняется во времени, то и
скорость непрерывно меняется во
времени.
Факторы,
влияющие на скорость реакции:
-
Природа
реагирующих веществ.
Необходимым, но недостаточным условием
осуществления химического взаимодействия
между частицами является их столкновение.
Взаимодействие происходит лишь в том
случае, если частицы приближаются на
расстояние, на котором становится
возможным перераспределение электронной
плотности. Следовательно частица
должна обладать некоторой энергией
для преодоление энергетического
барьера другой частицы, которая
называется энергией активации Ea. Для
атомов – это энергия отталкивания
между электронными облаками, для
молекул – энергия разрыва связей. -
Концентрация
реагентов.
Закон
действия масс:
скорость гомогенной реакции в каждый
момент времени пропорциональна
произведению концентрации реагирующих
веществ, возведенных в некоторую
степень. V=kCaNaCbNb.
K зависит от тех же факторов, что и сама
скорость. Численные значения k зависят
от выбора единиц времени и концентраций.
Na и Nb
– частные
порядки реакций,
их сумма называется общим порядком
реакции. Порядок реакции может принимать
произвольные значения. Порядок реакции
совпадает со стехиометрическими
коэффициентами, если реакция простая
и концентрация первого вещества
искуственно поддерживается постоянной.
Молекулярность
реакции –определяется
числом частиц, одновременно сталкивающихся
и приводящих к химическим превращениям.
Кинетическое
уравнение реакции первого порядка:
, где
k
— константа скорости, С — концентрация.
Время
полупревращения (полураспада):
Зависимость
от температуры.
Скорость большинства реакций с ростом
температуры возрастает, т.к. повышается
число активных частиц. Зависимость
скорости реакции от температуры
приблизительно выражается правилом
Ван-Гоффа:
скорость реакции при повышении
температуры на каждые десять градусов
возрастает в 2-4 раза. V2
/V1=γ
(T2-T1)/10
где γ – температурный коэффициент
Вант-Гоффа. Более точное выражение
дает уравнение
Аррениуса:
k=Aexp(-Eа/RT),
где R-универсальная
газовая постоянная, A=pz, p-стерический
фактор, учитывающий ориентацию
столкновения, z-общее число столкновений,
A-предэкспоненциальный
множитель.
Энергия
активации:
средняя избыточная энергия системы
необходимая для совершения химического
превращения.
Катализом
называется изменение скорости реакции
под влиянием катализатора – вещества,
повышающего скорость реакции, но не
расходуемого в ней.
Особенности
катализатора:
-
Не
влияет на общую стехиометрию. -
Одинаково
ускоряет как прямую, так и обратную
реакцию, сокращая время достижения
термодинамического равновесия. При
этом катализатор не влияет на константу
равновесия. -
Влияет
на механизм реакции, открывая новый
путь с меньшей энергией активации. -
Обладает
селективным действием, т.е может
ускорять один процесс, но не ускорять
другой. -
Расходуется
в одной стадии, но восстанавливается
в последующей.
Виды
катализа: гомогенный(реагенты и
катализатор находятся в одной фазе(в
растворе или смеси газов)), гетерогенный.
Билет
№8. Растворы. Способы выражения
концентрации. Особенности воды как
растворителя. Водородный показатель.
Электролитическая диссоциация.
Константа и степень диссоциации слабых
электролитов. Закон разбавления
Оствальда.
Раствор
— химическая система включающая минимум
2 компонента, растворенное вещество
и растворитель.
Способы
выражения концентрации растворов:
-
Массовая
доля растворённого вещества ω: равная
отношению массы растворённого вещества
к общей массе раствора m. -
Молярная
концентрация C: показывает, сколько
моль растворённого вещества содержится
в 1 литре раствора.
Наиболее
распространенным растворителем
является вода.
Вода, как полярный растворитель,
гидротирует заряженные частицы и при
этом выделяется теплота гидратации.
Вода уменьшает взаимодействие ионов
в растворе, т.к. обладает большой
диэлектрической проницаемостью
(e=78).
*
Для характеристики кислотности
(щелочности) среды введен специальный
параметр – водородный
показатель
среды pH, определяемый как взятый с
обратным знаком десятичный логарифм
концентрации ионов водорода в растворе:
pH=-lgСH+.
По аналогии с pH вводится и pOH=-lgСOH-.
Водородный показатель определяет
характер раствора. При 295К среда
нейтральна при pH=7. При росте температуры
pH нейтральной среды возрастает.
*
Процесс распада электролитов на ионы
в водных растворах и расплавах
называется электролитической
диссоциацией.
Основные положения теории электролитической
диссоциации Аррениуса:
*
При растворении в воде молекулы
электролитов диссоциируют на
положительно и отрицательно заряженные
ионы.
*
Диссоциация – обратимы процесс. Как
правило он не протекает до конца и в
системе устанавливается динамическое
равновесие.
*
Ионы в водном растворе находятся в
хаотическом движении.
Диссоциацию
слабого электролита
можно охарактеризовать константой
равновесия, называемой константой
диссоциации Кд.
Из значения константы диссоциации
можно оценить силу электролита:
меньшему значению Кд соответствует
более слабый электролит и наоборот.
Для слабых электролитов Кд для данной
температуры является постоянной
величиной (не зависит от концентрации
электролита). Для количественной
характеристики электролитической
диссоциации вводится понятие степени
диссоциации,
равной отношению количества электролита,
распавшегося на ионы, к общему количеству
этого вещества, введенного в раствор.
Степень диссоциации является
безразмерной величиной.
Закон
разбавления Освальда:
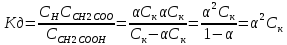
Билет
№9. Коллоидные растворы. Дисперсные
системы и области их применения.
Строение мицеллы. Правило Пескова-Фаянса.
Адсорбция. Свойства коллоидных
растворов (агрегативная и кинетическая
устойчивость, седиментация, коагуляция,
оптические и электрические). Методы
получения и разрушения коллоидных
систем.
Коллоидные
системы–это
высоко дисперсные гетерогенные
системы, характеризующиеся сильно
развитой поверхностью раздела фаз.
Дисперсные
системы
(раздробленные и гетерогенные) состоят
из сплошной непрерывной среды –
дисперсной фазы и раздробленных частиц
– дисперсной среды.
Мицеллы
— частицы
в коллоидных системах, состоят из
нерастворимого в данной среде ядра
очень малого размера, окруженного
стабилизирующей оболочкой адсорбированных
ионов и молекул растворителя.
Строение
мицеллы: Состоит
из 1) ядра, 2)Адсорбционного слоя,
3)Диффузного слоя.
Правило
Пескова-Фаянса:
ядро мицеллы адсорбирует из раствора
преимущественно те ионы, которые
входят в кристаллическую решетку ядра
или являются изоморфным с ним и
содержатся в некотором избытке.
Изоморфизм- способность частиц замещать
друг друга из-за одинаковых размеров.
Адсорбция
— поглощение вещества из газовой или
жидкой среды поверхностным слоем
твердого тела (адсорбента) или жидкости.
Адсорбция применяется во многих
отраслях медицины, а также является
одним из свойств кожи и слизистых
оболочек.
Методы
получения коллоидных растворов:
-
Механические
– диспергирование (механическое
дробление). -
Химические
– пептизация (химическое дробление).
Свойства
коллоидных растворов
-
Устойчивость.
Кинетическая
– постоянство концентрации дисперсной
фазы (обусловлена броуновским
движением). Агрегативная
– постоянство дисперсной фазы
(обусловлено наличием у частиц
одноименного заряда и как следствие
– отталкивание). Более устойчивы
гидрофильные золи (коллоидная частица
взаимодействует с водой). Гидрофобные
золи (смачиваемые водой) менее
устойчивы. -
Электрические.
Перемещение гранул под действием
электрического тока называется
электрофорезом. Обусловлено наличием
заряда у частиц. -
Оптические.
Способность коллоидных растворов
рассеивать свет (в отличие от истинных
растворов). Вследствии дифракции
света на коллоидных частицах в
коллоидном растворе происходит
светорассеивание, которое становится
видимым при наблюдении сбоку (конус
Тиндаля). -
Коагуляция
– укрупнение коллоидных частиц из-за
частичной или полной потери
электрического заряда при добавлении
электролита. При полной потере заряда
коагуляция приводит к разрушению
коллоидной системы.
Гидрофобные золи весьма чувствительны
к добавлению электролита. Чем выше
заряд коагулирующего иона, тем сильнее
его действие. Наименьшая концентрация
электролита при которой возникает
коагуляция называется порогом
коагуляции C=1/z6=Cэл-та*Vэл-та/(Vзоля+Vэл-та).
В
целом разрушение можно вызвать 4
способами:
механическим, электрическим,
термическим, добавлением электролита.
Билет
№10. Комплексные соединения. Классификация.
Типичные комплексообразователи и
лиганды. Координационное число.
Взаимосвязь строения комплексов и
гибридизации орбиталей
комплексообразователей. Внутрикомплексные
соединения. Двойные соли. Константы
нестойкости. Разрушение комплексов
с использованием реакций осаждения.
*Комплексные
соединения
– называются сложные соединения, у
внутренняя сфера которых образованная
с участием донорно-акцепторных связей,
способна к самостоятельному существованию
как в растворах и расплавах, так и в
узлах крист. решетки.
*Комплексообразователь
– центральный атом, нейтральный атом
или ион. Типичными
комплексообразователями
являются катионы d
и f элементов,
имеющие вакантные орбитали.
*Лиганды
– анионы (F‾, Cl‾, NH3‾),
нейтральные молекулы имеющие
неподеленные электронные пары.
Лигандами
могут быть
молекулы и анионы бескислородо или
кислородо содержащих кислот. Лиганды,
занимающие одно координационное
место, называются монодентатными
(например, NH3—,
Cl—),
два — бидентатными (CO32-,
C2O42-).
Лиганды, способные занять большее
количество мест, обычно обозначают
как полидентатные.
*Координационное
число
– число мест вокруг комплексообразователя,
занятых лигандами.
Типы
комплексов:
-
Катионные
[Cu(NH3)4]І+ -
Анионные
[HgI4]І‾ -
Нейтральные
(молекулярные; не имеют внешней сферы):
[Fe(CO)5]°, [Co(NH3)3(NO2)3]°.
Взаимосвязь
строения комплексов и гибридизации
орбиталей комплексообразователей:
—
число гибридных орбиталей соответствует
КЧ комплексообразователя.
*Внутрикомплексные
соединения(хелатные соединения) –
циклические
соединения, в которых центральный
атом входит в состав одного или
нескольких циклов из ковалентных
связей по донорно-акцепторному или
обменному механизму.
*Двойные
соли
– являются сильными электролитами и
в растворах диссоциируют полностью,
т.к. связи между катионами металла и
анионами кислотного остатка носят
ионный характер: KAl(SO4)2K++Al3++2SO42-
-
Разрушение
комплекса.
Комплекс
может быть разрушен или кислотой или
реагентом, который может образовать
с центральным атомом труднорастворимое
соединение. [Ag(NH3)2]OH
+ 3HNO3
= AgNO3
+ 2NH4NO3
+ H2O
Чтобы
определить разрушится ли комплекс
при добавлении реактива, дающего с
ионами комплексообразователя
малорастворимые соединения, нужно
рассчитать ПК(произведение концентрации)
и сравнить с ПР.
Для
расчета ПК требуется определить
концентрацию ионов комплекса по
численному значению Кн.
Кн
– константа
нестойкости,
характеризует относительную устойчивость
комплексного иона. Если ПК>ПР – то
комплекс может быть разрушен.
Билет
№11. Электрохимические процессы.
Окислительно-восстановительные
реакции. Окислители и восстановители.
Методы составления уравнений ОВР.
Направление реакций ОВР. Двойной
электрический слой, электродный
потенциал, гальванический элемент,
электродвижущая сила. Уравнение
Нернста.
В
основе электрохимических процессов
лежат ОВР.
*Электрохимический
процесс
– процесс взаимного превращения
химической и электрической форм
энергии.
*Окисли́тельно-восстанови́тельные
реа́кции (ОВР)
— Химические реакции, протекающие с
изменением степени окисления элементов,
входящих в состав реагирующих веществ.
*Восстановителем
является
атом, молекула или ион, отдающий
электроны.
*Окислителем
является атом, молекула или ион,
принимающий электроны.
Окисление
— это
процесс отдачи электронов атомом,
молекулой или ионом. Если атом отдает
свои электроны, то он приобретает
положительный заряд.
Восстановление
— это процесс присоединения электронов
атомом, молекулой или ионом. Если атом
присоединяет электроны, то он
превращается в отрицательно заряженный
ион.
Методы
составления уравнения ОВР:
-
Электронного
баланса
складывается из следующих этапов:
а)
записывают схему реакции (формулы
реагентов и продуктов), а затем находят
элементы, которые повышают и понижают
свои степени окисления, и выписывают
их отдельно: MnCO3
+ KClO3
→ MnO2
+ KCl
+ CO2;
Cl5+
→ Cl−;
Mn2+→
Mn4+
б)
составляют уравнения полуреакций
восстановления и окисления, соблюдая
законы сохранения числа атомов и
заряда в каждой полуреакции: полуреакция
восстановления Cl5+
+ 6e− = Cl−;
полуреакция окисления Mn2+−
2e− = Mn4+
в)
подбирают дополнительные множители
для уравнения полуреакций так, чтобы
закон сохранения заряда выполнялся
для реакции в целом, для чего число
принятых электронов в полуреакциях
восстановления делают равным числу
отданных электронов в полуреакции
окисления: Cl5+
+ 6e− = Cl−
* 1; Mn2+
− 2e− = Mn4+
* 3
г)
проставляют (по найденным множителям)
стехиометрические коэффициенты в
схему реакции (коэффициент 1 опускается):
3MnCO3
+ KClO3
= 3MnO2
+ KCl + CO2
д)
уравнивают числа атомов тех элементов,
которые не изменяют своей степени
окисления при протекании реакции
(если таких элементов два, то достаточно
уравнять число атомов одного из них,
а по второму провести проверку).
Получают уравнение химической реакции:
3MnCO3
+ KClO3
= 3MnO2
+ KCl + 3CO2
-
Метод
электронно-ионного баланса
складывается из следующих этапов:
а)
записывают формулы реагентов данной
реакции: K2Cr2O7
+ H2SO4
+ H2S
и устанавливают химическую функцию
каждого из них (здесь K2Cr2O7
−
окислитель, H2SO4
− кислотная среда реакции, H2S
− восстановитель);
б)
записывают (на следующей строчке)
формулы реагентов в ионном виде,
указывая только те ионы (для сильных
электролитов), молекулы (для слабых
электролитов и газов) и формульные
единицы (для твердых веществ), которые
примут участие в реакции в качестве
окислителя (Cr2O72−
), среды (Н+
− точнее, катиона оксония H3O+)
и восстановителя (H2S):
Cr2O72−
+ H+
+ H2S
в)
определяют восстановленную форму
окислителя и окисленную форму
восстановителя, что должно быть
известно или задано (так, здесь
дихромат-ион переходит катионы
хрома(III), а сероводород − в серу); эти
данные записывают на следующих двух
строчках, составляют электронно-ионные
уравнения полуреакций восстановления
и окисления и подбирают дополнительные
множители для уравнений полуреакций:
полуреакция
восстановления Cr2O72− + 14H+ + 6e− = 2Cr3+ +
7H2O * 1
полуреакция
окисления H2S − 2e− = S(т) + 2H+ * 3
г)
суммируя уравнения полуреакций,
составляют ионное уравнение данной
реакции, т.е. дополняют запись (б):
Cr2O72−
+ 8H+ + 3H2S = 2Cr3+ + 7H2O + 3S(т)
д)
на основе ионного уравнения составляют
молекулярное уравнение данной реакции,
т.е. дополняют запись (а):
K2Cr2O7
+ 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т)
+ K2SO4
Для
определения направление самопроизвольного
протекания окислительно-восстановительной
реакции
необходимо вычислить ЭДС реакции :
ЭДС=Е(ок-ля)-Е(вос-ля),
ЭДС<0 – в обратном, ЭДС>0 – в прямом.
Двойной
электрический слой
— тонкий поверхностный слой из
пространственно разделенных
электрических зарядов противоположного
знака, образующийся на границе двух
фаз.
Электро́дный
потенциа́л
— разность электрических потенциалов
между электродом и находящимся с ним
в контакте электролитом.
*Электрод
– проводник, имеющий электронную
проводимость и находящийся в контакте
с ионным проводником.
Гальванический
элемент
– электрохимическая система
преобразующая химическую энергию в
электрическую.
-
Уравнение
Нернста для электродного потенциала.
Meoвос.фаза
–
Ze˗Me+Zок.фаза
– электродная реакция
E
= E° + (RT/ZF)*ln(С(ок.фаза)/С(вос.фаза)), где
F = 96485 kл/моль(число Фарадея), Z – зарядовое
число аниона
Измерить
отдельный электродный потенциал
нельзя, а можно измерить разность двух
электродов. По этому пользуются
системой относительных электродных
потенциалов. Потенциал станд. водородного
электрода принимают равным нулю при
любой температуре.
Билет
№12. Коррозия металлов. Виды коррозии.
Специфика электрохимической коррозии.
Примеры коррозии в системах цинк-медь,
железо-цинк. Методы защиты от коррозии.
Коррозия
– это разрушение металла в результате
его физико-химического взаимодействия
с окружающей средой.
Виды
коррозии (По механизму протекания):
-
Химическая-происходит
прямое гетерогенное взаимодействие
металла с окислителем окружающей
среды:
а)
Газовая коррозия: В газах и парах без
конденсации влаги на поверхности
металла, обычно при высоких температурах
(окисление металла кислородом воздуха).
б)
Коррозия в неэлектролитах: В агрессивных
жидкостях, таких как сернистая нефть
и т.д.
-
Электрохимическая
— характерна для сред имеющих ионную
проводимость. При электрохим. коррозии
процесс взаимодействия металла с
окислителем включает анодное окисление
металла и катодное восстановление
окислителя. Может протекать: в
электролитах, в атмосфере любого
влажного газа, в почве.
Методы
защиты от коррозии.
-
Протекционная
защита
(К предмету подключается деталь из
более активного металла, которая
будет разрушаться.) -
Катодная
защита-это
электрохимическая защита, основанная
на наложении отрицательного потенциала
на защищаемую деталь. -
Металлическое
покрытиеб)
Катодное покрытиеанод:
Fe
– 2e
= FeІ+катод:
2H+
+ 2e
= H2
(Sn)Fe
| FeІ+
| H+
| H2
(Sn)
a)
Анодное покрытие:
Более
активный металл, долговременная защита
анод:
Zn – 2e = ZnІ+
катод:
2H+
+ 2e = H2
(Fe)
Zn
| ZnІ+
| H+
| H2
(Fe)
-
Покрытие
из лаков, красок -
Лигирующие
добавки. При лигировании в состав
сплава вводят компоненты, вызывающие
пассивность металла. В качестве таких
компонентов применяют хром, никель,
вольфрам.
Окислителями
при коррозии служат молекулы О2,
Cl2,
H+,
FeI+,
и др.
Билет
№13. Водород. Особенности его положения
в ПСЭ. Химические свойства.
Водород
– самый распространенный элемент во
вселенной и широко распространенный
на Земле. Содержание его в земной коре
сост. 3% (масс. доля)
Электронная
конфигурация:
1S1.
По
своей восстановительной способности,
он имеет сходство с S – элементами
первой группы.
-
Однако
водород характеризуется высокой
энергией ионизации, способен принимать
один электрон для завершения первой
оболочки. По этому его иногда помещают
в 7 группу периодической системы. В
тоже время водород не относится к p-
элементам, по этому его место как в 7
так и в 1 группе – условно.
Водород
имеет три изотопа:
протий 1H,
дейтерий 2H
и тритий 3H,
причем тритий – радиоактивны изотоп.
Химические
свойства водорода:
-
Молекулы
водорода Н2
довольно прочны, и для того, чтобы
водород мог вступить в реакцию, должна
быть затрачена большая энергия: Н2
= 2Н − 432 кДж -
Поэтому
при обычных температурах водород
реагирует только с очень активными
металлами, например с кальцием, образуя
гидрид кальция: Ca + Н2
= СаН2 -
и
с единственным неметаллом — фтором,
образуя фтороводород: F2
+ H2
= 2HF -
С
большинством же металлов и неметаллов
водород реагирует при повышенной
температуре или при другом воздействии,
например при освещении: О2
+ 2Н2
= 2Н2О -
Взаимодействие
с оксидами металлов: CuO + Н2
= Cu + Н2O -
Восстановительные
свойства водорода: N2
+ 3H2
→ 2NH3
Билет
№14. Свойства s- и d-металлов I и II групп.
Сравнение строения и реакционной
способности.
-
Атомы
S – металлов имеют на внешнем электронном
уровне соответственно 1 или 2 электрона
nS1
или nS2.
Степени окисления их ионов в большинстве
случаев равны +1, +2. По мере увеличения
порядкового номера атомов растут их
радиусы и уменьшаются энергии
ионизации. Все S- металлы, кроме бериллия
имеют невысокие значения температур
плавления. Значения их стандартных
электродных потенциалов ниже – 2.0 В
(кроме бериллия).
Все
S – металлы (кроме бериллия и магния)
бурно реагируют с водой с выделением
водорода.
M
+ H2O = MOH + (1/2)H2
M
+ 2H2O = M(OH)2 + H2
Реакционная
способность S
– металлов с водой возрастает с
увеличение атомного номера в группе.
Щелочные
металлы.
Все
они – очень химически активные
вещества, причем их активность
возрастает от Лития к Францию. Так
Рубидий и Цезий реагируют с водой с
взрывом, Калий с воспламенением
выделяющегося Водорода, а Натрий и
Литий без возгорания.
С
кислотами взаимодействуют бурно
(опасно), восстанавливая их до низшей
степени окисления, например:
8Na
+ 4H2SO4 = Na2S + 3Na2SO4 + 4H2O
Металлический
Литий применяют также в термоядерных
реакторах для получения Трития.
(6,3)Li
+ (1,0)n = (3,1)H + (4,2)He
Билет
№15. Свойства d-элементов
3 группы и 4f-элементов.
Лантаноиды. Лантаноидное сжатие.
Зависимость химических свойств
лантаноидов от степени их окисления.
Свойства церия и европия. Основные
методы разделения. Области применения
РЗЭ и их соединения.
-
d-элементы:
Sc,
Y, La, Ac. Электронная формула: Э[…]
( n-1)d1ns2 -
f-элементы:
Ln(Ce-Lu), An(Th-Lr). Электронная
формула:
Ln[…]
4f1-14[5s25p6]5d0(1)6s2,
An[…] 5f2-146d0(1)7s2
Общие
свойства элементов III
группы:
-
Все
элементы имеют общую валентность III
и общий состав химических соединений. -
Элементы
характеризуются металлическими
свойствами, за исключением бора. -
Для
оксидов и гидроксидов характерны
основные свойства, кроме Al,
Ga,
Sc. -
Элементы
имеют подобные растворимые и
нерастворимые соединения.
Различные
свойства:
-
Элементы
главной подгруппы имеют иное электронное
строение. Являются р-элементами (менее
активные металлы). -
d-
и f-
элементы имеют на внешнем уровне ns-
два электрона, поэтому являются
типичными металлами. -
Различие
в свойствах элементов побочных подгупп
определяется электронным строением
предшествующих электронных слоев.
Лантаноиды
– элементы, следующие за лантаном и
имеющие сходные с ним свойства.
Радиусы
атомов и ионов РЗЭ уменьшаются от La
к Lu
– эффект
«лантаноидного сжатия».
Зависимость
химических свойств лантаноидов от
степени их окисления: ???
Свойства
Церия:
-
Электронная
конфигурация атома церия Се[…]
4f2[5s25p6]5d06s2. -
Церий
активный металл. -
Церий
взаимодействует при нагревании с
большинством неметаллов (O2,
H2,
N2,
Cl2,
С, S,
P
и т.д.) с образованием бинарных соед.
2Ce+N2(450-500oC)
2CeN
-
Бурно
взаимодействует с кислородом:
Ce+O2CeO2 -
Реагирует
с водой с выделением H2.
В ряду активности Церий и др. лантаноиду
можно расположить между Ca
и Mg: -
Ce+3H2OCe(OH)3+3H2
Свойства
Европия:
Во
влажном воздухе покрывается
оксидно-гидроксиой пленкой. Пассивируется
в холодной воде, реагирует с ней в
щелочной среде.
Сильный восстановитель; окисляется
горячей водой, кислотами, хлором,
серой.
Ион Еu2+
имеет светло-желтую окраску (почти
бесцветен), ион Еu3+
— светло-розовую
(почти бесцветен).
Области
применения РЗЭ и их соединения. (РЗЭ:
La, I, Ce-Eu)
Редкоземельные
элементы используют в различных
отраслях техники: в радиоэлектронике,
приборостроении, атомной технике,
машиностроении, химической
промышленности, в металлургии и др.
Широко применяют La, Ce, Nd, Pr в стекольной
промышленности в виде оксидов и других
соединений. Эти элементы повышают
светопрозрачность стекла. Редкоземельные
элементы входят в состав стекол
специального назначения, пропускающих
инфракрасные лучи и поглощающих
ультрафиолетовые лучи, кислотно- и
жаростойких стекол. Большое значение
получили редкоземельные элементы и
их соединения в химической промышленности,
например,
в
производстве пигментов, лаков и
красок, в нефтяной промышленности
как катализаторы. Редкоземельные
элементы применяют в производстве
некоторых взрывчатых веществ,
специальных сталей и сплавов, как
газопоглотители.
Еu
+ 2Н2О
= Еu(ОН)2
+ Н2.
2Eu
+ 6Н2О
(гор.) = 2Eu(OH)3
+ 3H2
2Eu
+ 6НС1 (разб.) =
2EuCl3
+ 3H2
Eu
+ 6HNO3
(конц.)
= Eu(NO3)3
+ 3NO2
+ 3H2O.
4Eu
+ 3O2
= 2Eu2O3
4Eu
+ 6H2O
+ 3O2
= 4Eu(OH)3.
2Eu
+ 3C12
= 2EuCl3
2Eu+3S=Eu2S3(бел.)
Eu
+ Eu2S3
= 3EuS (кор.-фиол.)
Основные
методы разделения-???
Билет
№16. Свойства 5f- элементов (актиноиды).
Особенности электронного строения.
Сопоставление свойств лантаноидов и
актиноидов в реакциях комплексообразования.
Свойства тория, урана и их соединений.
Свойства химических соединений
актиноидов в различных степенях
окисления.
Актиноиды
— элементы, следующие за Актаном (Th-Lr)
и имеющие сходные с ним свойства.
Особенности.
-
Электронное
строение: Э[…] 5f 2-146d0(1)7s2 -
Наиболее
тяжелые элементы следуют за актинием. -
Все
элементы претерпевают радиоактивный
распад. -
Различие
в энергиях 5f-
и 6d-
орбиталей меньше, чем 4f-
и 5f-
орбиталей
Радиусы
атомов и ионов актиноидов уменьшаются
с ростом порядкового номера –
актиноидное сжатие.
Свойства
тория.
Th
[ ] 5f1
[ ] 6d1
7s2,
+3, аналог R
Th
[ ] 5f0 [ ] 6d2 7s2 +4, аналог
4d: Zr, Hf.
Th
+ O2 -> ThO2. Взрыв.
Получение:
Тh3(РO4)4
+ 12NaOH -> (t) -> 3Th(OH)4 + 4Na3РO4.
Свойства
соединений тория Th^(+4).
Th(N03)4
+ 4NaOH -> Th(OH)4| + 4NaN03.
Th(OH)4
+ NaOH не
идет.
Th(OH)4
+ 4HCI -> ThCl4 + 4H20.
Тh(NО3)4
+ 2Na2C03 + H2O -> ТhОСО3
+ 4NANO3 + Н2О
+ CO2.
ThOCO3
+ 3Na2C03 + H2O -> Na4[Тh(СО3)4]
+ 2NaOH. Kч=8.
Th(N03)4
+ 2(NH4)C2O4 -> Th(C204)2 + 4NH4NO3.
Th(C204)2
+ 2(NH4)C204-> (NH4)4[Th(C204)4] K4=8.
ThF4
+ 4Na2C03 -> Na4[Th(CO3)4] + 4NaF.
Th(N03)4
+ K4[Fe(CN)6] -> Th[Fe(CN)6] + 4KN03.
Th[Fe(CN)6]
+ 4Na2C03 -> Na4[Th(C03)4] + Na4[Fe(CN)6].
Качественные
реакции на Th^(+4)
Th(N03)4
+ HCI + «торон» -> соединение
малинового цвета.
H2O
+ HCI + «торон»—> соединение
оранжевого цвета.
Отделение
тория.
От
Ce^(3+) and R^(3+)
Кислотно-основное:
R(ОН)3
+ ЗНСl -> (рН = 6,5) -> RCl3 + 3H2O.
Th(OH)4
+ 4НСl
-> (рН
= 3) -> ThCl4 + 4H2O.
2Се(ОН)3
+ 8НСl -> (рН = 1) -> 2СеСl3 + Cl2 + H2O.
Комплексообразование
(Th^(+4) — мощный комплексообразователь):
ThCl4
+ (NH4)2C2O4
-> (NH4)4[Th(C204)4]
+ 4NH4Cl
RСl3
+ 3{NH4)2C204 -> R2(C204)3 + 3NH4CI.
От
(UO2)^(+2), Th^(+4)
На
образоваии труднорастворимых фторидов.
ThCl4
+ 4KF -> ThF4 + 4KCI.
UO2Cl2
+ 2KF -> UO2F2 (раствор) + 2KCI.
На
комплексообразовании:
ThCl4
+ 4(NH4)2C2O4 -> (NH4)4[Th(C2O4)4]^(4-) + 4NH4CI.
2RCI3
+ Na2C2O4 -> R2(С2О4) + NaCI.
От
U^(+6)
ThCl4
+ 4KF -> ThF4 + 4KCI.
UO2Cl2
+ 2KF -> UO2F2 (раствор)
+ 2KCI.
Получение
тория.
Th(C2O4)2
-> (t) -> ThO2 + 2CO + 2CO2.
Металлотермия:
Th02 + Ca -> (t) -> Th3 + CaO. Без
воды. Иначе взрыв.
Электролиз
расплава: K2[ThFe6](KCI, NaCI) -> Th3 (порошкообразный)
+ Cl2.
Иодидное
рафинирование (газотранспортные
реакции):
ThI4
(Дельта, ну треугольничик такой)Th +
2I2. Th02/Th3N4/ThC+l2
не
идёт.
1
зона: Th + I2 -> (t) -> Thl4 (газ) -> во вторую
зону.
2
зона:
Thl4 -> (t) -> Th (чистый)
+ 2I2.
Свойства
урана.
U
[ ] 5f 3 6d 1 7s 2 +3 (малоустойчив, аналог
R^(+3))
U
[ ] 5f 2 6d 2 7s 2 +4 (уст,
аналог
Th, Ti, Zr. Hf)
U
[ ] 5f 1 6d 3 7s 2 +5 (неустойчив)
U
[ ] 5f 0 6d 4 7s 2 +6, (аналог
Cr(+6), Mo(+6), W(+6) [S(+6)].
Свойства
металлического урана.
Активен
(Фи)(U(+4)/U) = — 1,2 V.
a
— распад, t полураспада = 4*10^(9), tплавления
= 1100c.
U
+ O2 -> UO2; 2U +3O2 -> 2UO2; 3U + O2 -> U3O8 — защитная
плёнка.
2U
+ N2 -> 2UN; U+2C -> UC2; U + 3CI -> UCl6; U + 3F2 ->
UF6. UCl6
и UF6 —летучие газообразные.
Химические
свойства урана.
U^(+3)
(аналог R^(+3)) U^(+4) (аналог Th^(+4)).
Свойства
U(+6).
U(+6)
амфотерен и в растворе не присутствует
никогда. Пример амфотерности:
5U(S04)2
+ 2КМn04
+ 2H20 -> (рН
< 7) -” 5UO2SO4 + 2МnSO4
+ K2S04 + 2Н2S04.
2U(S04)2
+ Zn (восст)
-> U2(SO4)3 + ZnS04
Качественная
реакция на U(+4).
U(SO4)2
+ KF -> UF4 + K2SO4
U(SO4)2
+ К4[Fe(СN)6]
-> U[Fe(CN)6].
Гидролиз
солей U(+6).
U
+ Н2O (Дельта) U(ОН)4^(+2) +4Н+, рН < 7.
UO2(ОН2)
(основание) (Дельта)H2UO4 (кислота).
U(+6)
амфотерен. Примеры:
Взаимодействие
с кислотами: UO2(OH)2 + H2MeO4 -> UO2MeO4 + H2O.
Взаимодействие
с основаниями: 2UO2(OH)2 + 2NaOH -> Na2U2O7 + 2H2O.
Растворимость.
Растворимы:
UO2SO4,UO2Cl2,UO2(NО3)2.
Нерастворимы:
UO2(OH)2, MeU2O7, UO2HPO4.
Качественная
реакция на U(+4)
U(SO4)2
+ KF -> UF4 + К2SO4
UO2SO4
+ K4[Fe(CN)6] -> (UO2)[Fe(CN)6] (тёмно-коричневый)+
2K2SO4.
(UO2)2[Fe(CN)]
+ 6NaOH -> Na2U2O7 + Na4[Fe(CN)6].
Качественные
реакция на ион диоксоурана UO2(+2) .
2UO2(NO3)2+
K4[Fe(CN)6] -> (UO2)2[Fe(CN)6](кор)
+ 4КNО3
(UO2)2[Fe(CN)6]
+ 6Nа(ОН)(изб)
-> Nа2U2O7(жёлт)
+ Na4[Fe(CN)6] + 3H2O.
Комплексообразование.
Na2U2O
+ 6NаСО3
+ 3H20 -> 2Na4[UO2(CO3)3].
UO2SO4
(окислитель)
+ Zn + 2Н2SO4
-> U(SO4)2 + ZnSO4 + 2H2O.
Очистка
урана.
(примеси
— Ra) U3O8 + MnO2 + 4H2SO -> 3UO3SO4 (раствор +
примеси) + МnSO4 + 4Н2O.
1)
Ra + Н2SO4 -> RaSO4 + 2Н+. Очистка от активных
примесей.
2)
UO2SO4 + ЗNа2СО3
-> Na4[UO2(CO3)3] + Na2SO4. Карбонатная
очистка.
Очистка
урана от тория:
1
ст). Сорбция на твёрдом катиониде.
Th^(+4)
+ 4RНS03
-> Th(RSO3)3 + 4Н+
UO2
+ 2RHS03 -> UO2(РSO3)2
+ 2H+
2
ст) Десорбция. В качестве десорбента
используют раствор кислоты НСl разной
концентрации, который
подбирается
так, чтобы десорбция катионов происходила
сепективно (только по одному катиону).
Получение
урана.
Na4[UO2(СО3)3]
+ ЗН2SO4
-> UO2SO4 + 3U2CO3 + 2Na2SO4
Осаждение)
UO2SO4 + 2NaOH (мало)
-> UO2(OH)2 + 2Na2SO4
Термическое
разложение) UO2(OH)2 -> (t) -> UО3 + Н2O#
Восстановление)
UО3 + Н2 -> UO2 + Н2O
Синтез
фторида) UO2 + HF-> (t = 6ООс) -> UF4 + 2H2O
Металлотермия)
UF4 + Са -> (t > Тпл) -> U(плавл) + CaF2.
Свойства
соединений урана U^(+6).
UO2(NO3)2+2NaOH(мало)
-> UO2(OH)2 + 2NaNO3.
UO2(OH)2
+ 2NaOH(изб)
-> Na2U2O7 + 3H2O.
Na2U2O7
+ 6Na2CO3 + 3H2O -> 2Na4[UO2(CO3)3] + 6NaOH. КЧ=6;
UO2SO4
+ Zn + 2H2SO4 -> U(SO4)2 + ZnO4 + 2H2O
UO2SO4
+ NaF <—> UO2F2 + Na2SO4.
U(SO4)2+4NaF
-> UF4 + 2Na2SO4.
2UO2SO4
+ K4[Fe(CN)6] -> (UO2)2[Fe(CN)6] + 2K2SO4.
U(SO4)2+K4[Fe(CN)6]
-> U[Fe(CN)6] + 2K2SO4.
Министерство образования и науки РТ
ГАПОУ «Арский агропромышленный
профессиональный колледж»
ЭКЗАМЕНАЦИОННЫЕ
БИЛЕТЫ
по дисциплине: «Химия»
по профессии СПО
19.02.10«Технология продукции общественного
питания
Урняк, 2019
Директор
__________
Р.Р.Камалутдинов
Разработчик:
преподаватель __________/Галиева
З.Т./
Согласовано
на заседании МК преподавателей общеобразовательных дисциплин
Протокол
№ 11 от « 15 » апреля 2020 г.
Председатель
ЦМК _______/ Шайдуллина Л.Г./
Формой
итоговой аттестации является- экзамен.
Условием допуска к экзамену является
положительная текущая аттестация по всем лабораторным, практическим работам, а также всем видам контрольных и внеаудиторных работ учебной
дисциплины.
Экзамен
проводится устной форме, по билетам. Итогом экзамена является оценка знаний и
умений обучающегося по пятибалльной шкале.
Критерии оценки экзаменационной работы
обучающихся по « ХИМИЯ»:
Отметка «5» :
— ответ полный и правильный на основании изученных теорий;
— материал изложен в определенной логической
последовательности, литературным языком;
— ответ самостоятельный.
Ответ
«4» ;
— ответ полный и правильный на сновании изученных теорий;
— материал изложен в определенной логической
последовательности, при этом допущены две-три несущественные ошибки,
исправленные по требованию учителя.
Отметка
«З» :
— ответ полный, но при этом допущена существенная ошибка или
ответ неполный, несвязный.
Отметка
«2» :
— при ответе обнаружено непонимание обучающийся основного
содержания учебного материала или допущены существенные ошибки, которые
обучающийся не может исправить при наводящих вопросах учителя,
отсутствие ответа.
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Белки. Свойства. Применение. Получение.
2.
Скорость химической реакции.
Экзаменатор:
________Галиева З.Т
____________________________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Витамины.
Гормоны
2. Строение атома
Экзаменатор:
______Галиева З.Т
_______________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Классификация и
изомерия аминов
2.
Электролитическая диссоциация солей.
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Коррозия
металлов. Условия, при которых происходит коррозия, меры защиты металлов и
сплавов от коррозии.
2. Жиры
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Металлы главных
подгрупп, их положение в периодической системе химических элементов
Д.И.Менделеева, строение их атомов.
2.Нуклеиновые кислоты
Экзаменатор:
______Галиева З.Т
______________________________________________________________
ГАПОУ «Арский агропромышленный
профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Предмет
органической химии. Теория строения органических соединений, положения А. М.
Бутлерова.
2. Катализ.
Каталитические реакции
Экзаменатор:
______Галиева З.Т
_______________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 7
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.
Вода,
ее состав, строение молекулы, химические и физические свойства. Основные
загрязнители природной воды, очистка природных и сточных вод.
2.
Основные
законы в органической химии
Экзаменатор: ______Галиева З.Т
________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 8
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Общая
характеристика неметаллов 7 группы, строение их атомов, валентные возможности
атомов, характерные соединения.
2. Одноатомные
спирты. Свойства. Номенклатура
Экзаменатор:
______Галиева З.Т
_______________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Сложные вещества- соли. Их
свойства
2. Крекинг
нефтепродуктов Экзаменатор:
______Галиева З.Т.
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Типы
кристаллических решеток веществ.
2. Нефть. Фракции
нефти. Октановое число
Экзаменатор:
______Галиева З.Т
____________________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 11
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Основания и их
свойства.
2. Циклоалканы, их
гомологи
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 12
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Химическая
связь. Классификация
2. Алкены, их
химические свойства
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 13
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Окислительно-
восстановительные реакции.
2.Алканы, их
химические свойства
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 14
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.Гидроксиды.
классификация. Свойства.
2. Гомологический
ряд алкинов.Их получение. Свойства. Номенклатура.
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 15
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Гомологический
ряд альдегидов. Химические свойства
2.Искусственные
волокна
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 16
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.Аминокислоты. Свойства.
Номенклатура.
2.Основные
понятия химии.
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 17
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Алкадиены. Их
химические свойства
2. Углеводороды в
моей профессии
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский агропромышленный
профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 18
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Оксиды и их
свойства.
2. Природный и нефтяные газы.
Каменный уголь
Экзаменатор:
______Галиева З.Т
______________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 19
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.Ароматические
углеводороды
2.Периодический
закон и периодическая система химических элементов Д.И.Менделеева в свете
учения о строении атома. Значение периодического закона.
Экзаменатор:
______Галиева З.Т _________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 20
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Сложные эфиры.
Свойства и получение.
2.Металлы побочных
подгрупп, их положение в периодической системе химических элементов
Д.И.Менделеева, строение их атомов.
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 21
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.Синтетические
полимеры
2.Понятие об углеводах.
Экзаменатор: ______Галиева З.Т
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 22
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.Многоатомные
спирты
2.Соли и их
свойства
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский агропромышленный
профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 23
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1.Классификация
химических реакций
2.Карбоновые
кислоты, их представители. Получение
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 24
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Гомологический
ряд диеновых углеводородов
2. Кислоты и их
свойства
Экзаменатор:
______Галиева З.Т
_________________________________________________________
ГАПОУ «Арский
агропромышленный профессиональный колледж
«Согласовано»
«Утверждаю»
Председатель
методической комиссии Директор ГАПОУ
«ААПК»
_____________Шайдуллина
Л.Г. _______Р.Р. Камалутдинов
15.04.2020
15.04.2020
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 25
по учебному предмету «Химия»
для специальностей 19.02.10 «Технология
продукции общественного питания»
1. Амины.
Номенклатура. Свойства.
2. Дисперсные
системы
Экзаменатор:
______Галиева З.Т.
________________________________________________________
Экзаменационные билеты по химии.
Билет №1
Вопрос №1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
В 1869 году Д.И. Менделеев сформулировал Периодический закон:
Свойства химических элементов и их соединений находятся в периодической зависимости от заряда ядра.
На основании закона Д.И. Менделеев создал таблицу химических элементов. Таблица Менделеева по горизонтали делится на семь периодов. Период – это горизонтальный ряд элементов, который начинается щелочным металлом и заканчивается инертным газом.
Пример. 2 период начинается щелочным металлом литием Li и заканчивается инертным газом неоном Ne.
1,2, 3 периоды называются малыми. 4,5,6 периоды – большие периоды. 7 период – незавершенный.
По вертикали таблица делится на восемь групп. Группа – это вертикальный ряд элементов с одинаковой валентностью. Группа делится на главную и побочную подгруппы. Главную подгруппу составляют элементы малых и больших периодов. Побочную подгруппу составляют элементы только больших периодов. В подгруппе элементы имеют общие химические свойства.
Пример. 1 группа главная подгруппа – Li, Na, K, Rb, Cs, Fr – щелочные металлы, растворяются в воде, сильные восстановители. 1 группа побочная подгруппа – Cu, Ag, Au – неактивные металлы, не взаимодействуют с водой и кислородом.
На пересечении периода и группы образуется клетка. В ней указан символ элемента, название элемента, порядковый номер элемента, относительная атомная масса элемента.
Пример. Кислород. Символ – О. Порядковый номер – 8. относительная атомная масса – 16.
Порядковый номер равен заряду ядра, числу электронов, числу протонов.
Вопрос №2. Предельные углеводороды. Метан: строение, получение, применение.
Предельными углеводородами называют углеводороды с незамкнутыми цепями, одинарными связями с общей формулой Сn H2n + 2.
ГОМОЛОГИЧЕСКИЙ РЯД ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ.
С Н4 – метан С2Н6 — этанС 3 Н8 — пропанС4 Н10 – бутан
С5 Н 12 – пентанС6 Н 14 – гексанС7 Н 16 – гептан
С8 Н18 – октанС9 Н 20 – нонанС10 Н22 – декан
Метан, этан, пропан и бутан – газы без цвета и запаха. От пентана до С17 Н36 – жидкости с характерным запахом бензина. Начиная с С18 Н38 – твердые вещества белого цвета, жирные на ощупь. Газообразные и жидкие углеводороды образуют взрывоопасные смеси с воздухом. Все предельные углеводороды горят, нерастворимы в воде. В промышленности предельные углеводороды получают из нефти и природного газа. Основным компонентом природного газа является метан – от 70 до 98%. При сгорании метана выделяется большое количество теплоты, поэтому метан является самым эффективным и дешевым топливом для теплоэлектростанций, котельных установок, доменных и стекловаренных печах, для двигателей внутреннего сгорания и дизельных двигателей. При сгорании метана воздух практически не загрязняется вредными веществами.
Применение. Метан является важным сырьем для химической промышленности. Из метана получают ацетилен, водород, сажу. Смесь твердых и жидких предельных углеводородов называют вазелином и применяют в парфюмерии, медицине и технике. Смесь твердых углеводородов называют парафином, используют для изготовления свечей и спичек.
Профессиональная образовательная программа: «Автомеханик»
Тестовые задания по предмету: Химия
Курс: 1
Преподаватель: Провоторова Галина Ивановна
1 вариант
|
№ п/п |
Вопросы |
Ответы |
|
1 |
Химический элемент — это |
а) вид атомов с одинаковым зарядом ядра; б) электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов; в) отрицательно заряженный ион; г) положительно заряженный ион. |
|
2 |
Ядро атома состоит из частиц: |
а) нейтронов и электронов б) протонов и нейтронов в) протонов и электронов г) нейтронов |
|
3 |
Электронная формула внешнего электронного слоя магния |
а)3S 1 б)3S 2р7 в) 3S 2р2 г) 3S 2 |
|
4 |
Периодичность в изменении свойств химических элементов является результатом |
а) периодического повторения числа электронов на внешнем уровне в атоме; б) возрастания заряда ядра; в) возрастания числа электронов на внешнем уровне; г) возрастания заряда ядра и числа электронов на внешнем уровне |
|
5 |
Для солей и основных оксидов характерен вид химической связи |
а) ионная б) ковалентная неполярная в) металлическая г) ковалентная полярная |
|
6 |
Аллотропные модификации — это |
а) О2 и О3 б) О2 и SО2 в) О2 и SО3 г) О2 и CО2 |
|
7 |
Реакция, уравнение которой Zn +2 HCl = ZnCl2 +H2↑ относится к реакциям: |
а) соединения б) разложения в) замещения г) обмена |
|
8 |
Истинные растворы имеют размеры дисперсных частиц |
а) менее 1 нм б) от 1 до 100 нм в) более100 нм г) равно 100 нм |
|
9 |
Кислоты имеют формулу |
а) СО2 б) Н2СО3 в) К2СО3 г) NaOH |
|
10 |
Объём газа водорода, образующегося при взаимодействии цинка массой 6,5 граммов с хлороводородной кислотой по уравнению реакции Zn +2 HCl = Zn Cl2 +H2↑ составляет: |
а) 22,4 л; б) 11;2 л; в)1,12 л; г) 2,24 л. |
|
11 |
Амфотерные соединения – это соединения, которые в зависимости от условий, взаимодействуют с веществами |
а) кислотами; б) основаниями; в) кислотами и щелочами; г) простыми веществами |
|
12 |
Серная кислота и гидрооксид натрия применяются в аккумуляторных батареях, так как они: |
а) неэлектролиты б) слабые электролиты в) сильные электролиты г) средние электролиты |
|
13 |
Применение металлов в качестве проводников основано на свойствах |
а) твёрдость б) электропроводность в) пластичность г) теплопроводность |
|
14 |
Скорость химической реакции горения серы в кислороде уменьшается при |
А) увеличении концентрации кислорода Б) повышении температуры В) понижении температуры Г) увеличении концентрации оксида серы (4) |
Вариант 2
|
№ п/п |
Вопросы |
Ответы |
|
1 |
Элемент алюминий — это |
А) металл Б) переходный В) неметалл Г) инертный |
|
2 |
Атом состоит из частиц: |
а) нейтронов и электронов б) протонов и нейтронов в) протонов и электронов г) из положительно заряженного атомного ядра и отрицательно заряженных электронов |
|
3 |
Электронная формула внешнего электронного слоя натрия |
а)3S 1 б)3S 2р5 в) 3S 2р2 г) 3S 2 |
|
4 |
В главных подгруппах с увеличением заряда ядра металлические свойства |
А) ослабевают. Б) не изменяются; В) усиливаются; Г) изменяются периодически. |
|
5 |
Простые вещества, образованные неметаллами, имеют связь |
А) ковалентная неполярная Б) ковалентная полярная В) металлическая Г) ионная |
|
6 |
Аллотропные модификации — это |
а) графит и алмаз б) графит и сера в) графит и фосфор г) графит и кремний |
|
7 |
Реакция, уравнение которой 2Fe(OH)3 = Fe2O3 +3H2O — Q относится к реакциям: |
а) соединения б) разложения в) замещения г) обмена |
|
8 |
Суспензии имеют размеры дисперсных частиц |
а) менее 1 нм б) от 1 до 100 нм в) более100 нм г) равно 100 нм |
|
9 |
Кислотный оксид углекислый газ имеют формулу |
а) СО2 б) Н2СО3 в) К2СО3 г) NaOH |
|
10 |
Относительная молекулярная масса воды Н2О составляет: |
А) 123; Б) 46; В) 18; Г) 44 |
|
11 |
Са не взаимодействует с веществами: |
а) CuCl2 б) HCl в)NaCl г) H2О |
|
12 |
Сокращённому ионному уравнению OH— +H+ = H2O соответствует молекулярное |
А) Ca(OH)2 + H2SO4 = CaSO4↓ +2H2O Б) CaCO3 = CaO + CO2↑ В) Сa(OH)2 +2Н Cl = СaCl2 + 2H2O Г) 2Fe(OH)3 = Fe2O3 +3H2O |
|
13 |
Сжиженный газ и жидкие углеводороды применяются в обслуживании автомобиля в качестве: |
А) моющих растворов; Б) для охлаждения радиаторов; В) электролитов; Г) горючего |
|
14 |
Равновесие химической реакции
Будет смещаться в сторону продукта реакции при |
А) применении катализатора Б) увеличении давления В) уменьшении давления Г) повышении температуры |
|
15 |
Техническое железо получают методом |
А) электролиз солей Б) восстановление коксом и оксидом углерода из железных руд В) гидрометаллургия Г) алюмотермия |
Вариант 3
|
№ п/п |
Вопросы |
Ответы |
|
1 |
Металлы — это элементы, атомы которых на внешнем уровне имеют |
а) 1 – 2 электрона, легко отдают их; б) больше 2 электронов, принимают их; в) 8 электронов; г) 2 – 3 электрона и образуют амфотерные соединения |
|
2 |
Заряд ядра определяется |
А) порядковым номером элемента Б) атомной молекулярной массой элемента В) количеством нейтронов Г) номером периода, в котором расположен элемент |
|
3 |
Укажите элемент с электронной конфигурацией 1s2 2s2 2p6 3s2 3p5 |
а) фосфор б) хлор в) бром г) алюминий |
|
4 |
В малых периодах с увеличением заряда ядра металлические свойства |
А) ослабевают. Б) не изменяются; В) усиливаются; Г) изменяются периодически. |
|
5 |
Химическая связь в молекулах нитрата натрия и хлора соответственно: |
А) ионная и ковалентная неполярная Б) ионная и ковалентная полярная В) металлическая и ковалентная полярная Г) металлическая и ковалентная неполярная |
|
6 |
Аллотропные модификации — это |
а) кислород и озон б) кислород и углекислый газ в) кислород и водород г) кислород и азот |
|
7 |
Ca(OH)2 + H2SO4 = CaSO4↓ +2H2O +Q |
а) соединения б) разложения в) замещения г) обмена |
|
8 |
Коллоидные растворы имеют размеры дисперсных частиц |
а) менее 1 нм б) от 1 до 100 нм в) более100 нм г) равно 100 нм |
|
9 |
Основание имеет формулу |
а) СО2 б) Н2 СО3 в) К2СО3 г) NaOH |
|
10 |
Сокращенное ионное уравнение реакции нейтрализации между гидрооксидом кальция и серной кислотой — это |
А) Ca(OH)2 + H2SO4 = CaSO4↓ +2H2O +Q Б) Сa2+ + 2OH— +2H+ +SO42- = CaSO4↓ + 2H2O+Q В) Сa2+ + 2OH— +2H+ +2Cl— = Сa2+ +2Cl — + 2H2O+Q Г) OH— +H+ =H2O+Q |
|
11 |
Кислоты взаимодействуют с веществами: |
а) кислотами; б) основаниями; в) кислотами и щелочами; г) неметаллами |
|
12 |
Относительная молекулярная масса углекислого газа СО2 составляет: |
А) 123; Б) 44; В) 18; Г) 46. |
|
13 |
Раствор соли карбоната натрия Na2CO3 применяют: |
А) для мойки двигателя автомобиля Б) для заливки в радиатор В) для зарядки аккумулятора Г) как топливо |
|
14 |
Укажите условия, при которых равновесие смещается в сторону образования аммиака
|
А) понижение температуры Б) понижение давления В) уменьшение концентрации исходных веществ Г) отказ от катализатора |
|
15. |
Сплавы железа: чугун и сталь получают методом |
А) электролиз солей Б) восстановление коксом и оксидом углерода из железных руд В) гидрометаллургия Г) алюмотермия |
Вариант 4
|
№ п/п |
Вопросы |
Ответы |
|
1 |
В настоящее время открыто общее количество элементов |
А) 63 Б) 100 В) 110 Г) 113 |
|
2 |
Число энергетических уровней в атоме определяется |
А) номером подгруппы, в которой находится элемент Б) номером периода В) порядковым номером Г) атомной молекулярной массой |
|
3 |
Электронная формула внешнего электронного слоя углерода |
а)3S 1 б)4S 2р5 в) 2S 2р2 г) 3S 2 |
|
4 |
С увеличением заряда ядра в главных подгруппах неметаллические свойства |
А) ослабевают. Б) не изменяются; В) усиливаются; Г) изменяются периодически. |
|
5 |
Ионная связь характерна |
А) НСl Б) NaCl B) Н2 Г) С |
|
6 |
Причины аллотропия углерода |
А) разное количество атомов Б) разные кристаллические решётки В) различия в свойствах Г) различная твёрдость |
|
7 |
 
N2 + 3H2 2NH3 + 92 кДж |
а) необратимая б) обратимая в) каталитическая г) некаталитическая |
|
8 |
Эмульсии это грубодисперсные системы с размером частиц |
а) менее 1 нм б) от 1 до 100 нм в) более100 нм г) равно 100 нм |
|
9 |
Амфотерные гидроксиды это |
а) СО2 б) Н2СО3 в) К2СО3 г) Al(OH)3 |
|
10 |
Масса оксида кальция, образующегося при разложении карбоната кальция массой 50 г? CaCO3 = CaO + CO2↑ |
А) 2,8 г; Б) 56 г; В) 28 г; Г) 5,6 г. |
|
11 |
Окислительно – восстановительные реакции |
А) Ca(OH)2 + H2SO4 = CaSO4↓ +2H2O +Q Б) CaCO3 = CaO + CO2↑ В) Сa(OH)2 +2Н Cl = СaCl2 + 2H2O Г) С2Н4 + Н2О = С2Н5 OH |
|
12 |
Среда кислая в растворе |
А) NaOH Б) HCl В) NaCl Г) NaNO3 |
|
13 |
Металл – основа чёрных сплавов |
А) медь Б) золото В) железо Г) магний |
|
14 |
Скорость химической реакции горения серы в кислороде 2S + 3O2 = 2SO3 уменьшается при |
А) увеличении концентрации кислорода Б) повышении температуры В) понижении температуры Г) увеличении концентрации оксида серы (4) |
|
15 |
Природным сырьём для промышленного производства негашёной извести (оксида кальция) служит |
А) известняк Б) кислород В) гидроксид кальция Г) сульфат кальция |
Вариант 5
|
№ п/п |
Вопросы |
Ответы |
|
1 |
Восьмую группу главную подгруппу образуют элементы |
А) металлы Б) неметаллы В) переходные Г) инертные |
|
2 |
Изотопы элементов имеют |
А) одинаковое число нейтронов Б) одинаковое массовое число В) разное число нейтронов Г) разное число протонов |
|
3 |
Электронная формула внешнего электронного слоя брома |
а)3S 1 б)4S 2р5 в) 3S 2р2 г) 3S 2 |
|
4 |
В периодах с увеличением заряда ядра неметаллические свойства |
А) ослабевают. Б) не изменяются; В) усиливаются; Г) изменяются периодически. |
|
5 |
Для металлов характерен вид химической связи |
А) ионная Б) ковалентная неполярная в) ковалентная полярная г) металлическая |
|
6 |
Явление существования нескольких веществ , образованных одним элементом, называется |
А) адсорбция Б) изомерия В) гомология Г) изомерия |
|
7 |
Реакция соединения, обратимая, экзотермическая, каталитическая |
Катал.
Б) CaCO3 = CaO + CO2↑- Q В) 2Fe(OH)3 = Fe2O3 +3H2O — Q Г) Zn +2 HCl = ZnCl2 +H2↑ + Q |
|
8 |
Смог — это дисперсная система, образующаяся в атмосфере |
А) при сочетании пылевых частиц и капель тумана; Б) при растворении твёрдых частиц в воде; В) при перемешивании масел в воде; Г) при перемешивании твердых частиц между собой |
|
9 |
Соль — это |
а) СО2 б) Н2СО3 в) К2СО3 г) Al(OH)3 |
|
10 |
Масса оксида кальция, образующегося при разложении карбоната кальция массой 5 г? CaCO3 = CaO + CO2↑ |
А) 2,8 г; Б) 56 г; В) 28 г; Г) 5,6 г. |
|
11 |
Щёлочи взаимодействую с веществами |
а) кислотами; б) основаниями; в) кислотами и щелочами; г) металлами |
|
12 |
Неэлектролиты — это |
А) хлорид натрия Б) серная кислота В) гидроксид натрия Г) бензин |
|
13 |
Сплавы в автомобилестроении применяют для производства |
А) шин Б) лобовых стёкол В) деталей двигателя Г) уплотнителей |
|
14 |
При увеличении концентрации оксида азота(2) в 3 раза скорость реакции 2NO + O2 = 2NO2 увеличится в |
А) 1,5 раза Б) 3 раза В) 6 раз Г) 9 раз |
|
15 |
Щелочные металлы и галогены получают методом |
А) электролиз Б) восстановление коксом В) гидрометаллургия Г) алюмотермия |
Спецификация теста.
|
Тестовые задания |
Контролируемые элементы знаний |
|
1 |
Элементы и их классификация |
|
2 |
Строение атома |
|
3 |
Электронное строение атомов химических элементов |
|
4 |
Периодическая система химических элементов Д.И. Менделеева |
|
5 |
Химическая связь в неорганических соединениях |
|
6 |
Аллотропия |
|
7 |
Классификация химических реакций |
|
8 |
Дисперсные системы |
|
9 |
Классификация и номенклатура неорганических веществ |
|
10 |
Определение молекулярной массы и решение задач |
|
11 |
Свойства соединений |
|
12 |
Теория электролитической диссоциации |
|
13 |
Применение химических соединений |
|
14 |
Скорость и химическое равновесие |
|
15 |
Промышленные способы получения |
Ответы
|
Тестовое задание |
Вариант № 1 |
Вариант № 2 |
Вариант № 3 |
Вариант № 4 |
Вариант № 5 |
|
1 |
а |
б |
а |
г |
г |
|
2 |
б |
г |
а |
б |
в |
|
3 |
г |
а |
б |
в |
б |
|
4 |
а |
в |
а |
в |
в |
|
5 |
а |
а |
а |
а |
г |
|
6 |
а |
а |
а |
б |
г |
|
7 |
в |
б |
г |
б |
б |
|
8 |
а |
в |
б |
в |
а |
|
9 |
б |
а |
г |
г |
б |
|
10 |
г |
в |
б |
в |
а |
|
11 |
в |
г |
б |
б |
а |
|
12 |
в |
в |
г |
б |
г |
|
13 |
б |
г |
а |
в |
в |
|
14 |
б |
г |
а |
б |
в |
|
15 |
г |
г |
б |
а |
г |

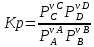
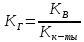 ,
,