Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО
А) сода
Б) углерод
В) бензол
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство пластмасс
2) производство стекла
3) производство бензина
4) производство чугуна
Запишите в таблицу выбранные цифры под соответствующими буквами.
Спрятать решение
Решение.
А) Соду используют при производстве стекла (2)
Б) Углерод входит в состав чугуна (4)
В) Основной областью применения бензола является органический синтез производных, из которых впоследствии получают различные продукты, в том числе и пластмассы. (1)
Ответ: 241.
Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
Область применения:
Аммиак — производство удобрений
Метан (природный газ) — в качестве топлива , энергетика
Изопрен — получение каучука
Этилен — получение пластмасс
капролактам — получение капрона
пропан — в качестве топлива
изопрен — получение каучука
стирол — получение полистирола
пропилен — получение
полипропилена
гидроксид аммония — в медицине
оксид кремния — получение стекол
сера — процесс вулканизации резины
тетрахлорид углерода — в качестве растворителя
ацетон — в качестве растворителя
углерод – для металлургия , для
производство чугуна
стирол — для производство
пластмасс
азот — для производство
удобрений
уксусная кислота — для производство
волокон, для пищевая промышленность
фосфорная кислота — для
производство удобрений
кислород — для металлургия
бензол — -для
производство пластмасс
хлор — для производство
пластмасс , производство органических растворителей
азотная кислота- для
производство удобрений
карбонат кальция – для
производство стекла
углекислый газ – для пищевая
промышленность
аргон создание инертной
атмосферы
карбонат натрия – для
производство стекла
озон — для очистка воды
кислород – для производство
стали
Полиэтилен – для игрушки,
пластиковые пакеты
политетрафторэтилен – для
тефлоновая посуда
изопреновый каучук — для автомобильные
шины
поливинилхлорид — для трубы,
оконные панели
поликарбонат — для пластиковые
бутыли, DVD-диски
полистирол – для контейнеры
для пищи
нефть – для
производства топлива
сода — для производство
стекла
водород –для производство
аммиака
кислород – для выплавка стали
бутадиен – для производство
пластмасс
Классификация:
Каучук — происхождение
-природный органический
Асбест- происхождение-
неорганический
Вискозное волокно- происхождение
-искусственный
Лен — происхождение -природный
органический
Поливинилхлорид —
происхождение -синтетический
Карбидное волокно — происхождение
-неорганический
Капрон — происхождение
-синтетический
Борное волокно- происхождение
— неорганический
Ацетатное волокно —
происхождение -искусственный
Винол — происхождение
-синтетический
Хлопок — происхождение
-природный органический
Кварцевое волокно —
происхождение -неорганический
Стекловолокно- происхождение —
неорганический
Нейлон- происхождение —
синтетический
Шелк — происхождение
-природный органический
Базальт- происхождение —
неорганический
Пенька- происхождение
-природный органический
Акрил- происхождение
-синтетический
Карбидкремниевое волокно-
происхождение — неорганический
Эластан- происхождение —
синтетический
Оксидное волокно —
происхождение -неорганический
Лайкра- происхождение —
синтетический
Триацетатное волокно —
происхождение -искусственный
Полиэстер- происхождение —
синтетический
Мономер-полимер:
винилхлорид — поливинилхлорид
хлорэтилен — поливинилхлорид
этилен — полиэтилен
пропен — полипропилен
винилбензол — полистирол
бутадиен — каучук
пропен — полипропилен
капролактам — капрон
терефталевая кислота —
полиэтилентерефталат
изопрен — каучук
этилен — полиэтилен
стирол — полистирол
тетрафторэтилен — тефлон
винилацетат — поливинилацетат
акриламид — полиакриламид
ацетилен — полиацетилен
этиленоксид — полиэтиленгликоль
винилбромид — поливинилбромид
Алюминий – из электролиз
расплава
железо – из восстановление
оксида углеродом
Натрий — электролиз расплава
кремний — восстановление оксида
углеродом
Аммиак -из воздуха
Стекло – из сода
этилен — из нефть
чугун – из магнитный железняк
Хлор — водный раствор хлорида
натрия
медь — халькопирит
полипропилен — получают из
пропилен
полиэтилен — получают из этилен
железо — получают из гематит,
пирит
Этанол — получают из древесина
Кислород — получают из воздух
углекислый газ — получают из
дымовые газы
фтор — получают из расплав
фторида калия
Процессы:
электролиз воды — получение
легких газов (водород, кислород)
крекинг нефтепродуктов —
получение бензина
перегонка (фракционирование)
сжиженного воздуха — получение легких газов (азот, кислород)
брожение древесины или соломы —
получение этанола
горение — получение тепловой
энергии
этерификация — получение
сложных эфиров
полимеризация — получение пластмасс и резины
вулканизация —
получение резины
перегонка (фракционирование)
сжиженного воздуха — получение легких газов (азот, кислород)
прокаливание фосфатов кальция с
углем и диоксидом кремния — получение фосфора
каталитическое окисление
диоксида серы в триоксид серы — получение серной кислоты
сшивание
молекул каучука в единую пространственную сеть — вулканизация
термическое или каталитическое
разложение тяжелых углеводородов — крекинг
присоединение воды к
непредельным соединениям — гидратация
реакция образования сложных
эфиров при взаимодействии кислот и спиртов — этерификация
присоединение водорода к
непредельным соединением с получением предельных соединений — гидрирование
замещение
водорода на галоген — радикальное галогенирование
присоединение воды к
непредельным соединениям — гидратация
присоединение водорода к
непредельным соединением с получением предельных соединений — гидрирование
переработка каменного угля —
коксование
Способ
разделения:
воды и октана — разделение с
помощью делительной воронки
воды и карбоната кальция
–разделение фильтрованием
железо и нитрат калия -с
помощью магнита
железо и магний — разделить с помощью
магнита
железа и меди -разделение с
помощью магнита
гексана и бензола — разделение фракционной
перегонкой
жидкий азот и кислород – разделяют фракционной
перегонкой
вода и пропанол —
фракционной перегонкой
вода и ацетон — разделить фракционной
перегонкой
вода и этанол -фракционной
перегонкой
поваренная соль и кварцевый песок —
-разделить обработка водой, фильтрование, выпаривание раствора
воды и бензола — декантацией
воды и сульфата бария —
фильтрованием
хлорид лития и кварцевый
песок -обработка водой
железа и хлорида стронция — с
помощью магнита
воды и фенол — декантацией
бутанола и этанола —
фракционной перегонкой
сульфат бария и хлорид калия
обработка водой
воды и тетрахлорметан — декантацией
алюминия и железа разделить с
помощью магнита
углерод и хлорид натрия —
обработка водой
изопропанол и этанол —
фракционной перегонкой
ацетон и изопропанол фракционной перегонкой
хлорид натрия и полиэтилен
обработка водой
Цвет
пламени:
соли борной кислоты- зеленое
пламя
соли стронция — карминово-красное
пламя
соли калия – фиолетовое пламя
соли меди — зеленое пламя
соли кальция — кирпично-красное
пламя
соли натрия — желтое пламя
соли калия — фиолетовое пламя
соли меди — зеленое пламя
соли бария —
желто-зеленое
соли лития — красное
Задание №1:
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате.
АППАРАТ:
А) печь кипящего слоя
Б) колонна синтеза
В) поглотительная башня
ПРОЦЕСС:
1) взаимодействие водорода и азота
2) окисление оксида азота(IV)
3) получение олеума
4) получение оксида серы(IV)
Решение:
Итак, рассмотрим первый пункт — печь для обжига в «кипящем слое».
Кипящий слой — это часть процесса производства серной кислоты, в которой совмещены твердая и жидкая фазы; при помощи этой технологии получают сернистый газ(SO2), ответ 4.
Колонна синтеза — это сложный аппарат, направленный на получение аммиака из водорода и азота, ответ 1.
Поглотительная башня используется при получении олеума(раствор SO3 в серной кислоте), ответ 3.
Задание №2:
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется при получении серной кислоты.
ПРОЦЕСС:
А) получение сернистого газа
Б) получение олеума
В) получение оксида серы(VI)
ОБОРУДОВАНИЕ:
1) окислительная башня
2) печь «кипящего слоя»
3) контактный аппарат
4) поглотительная башня
Решение:
Получение сернистого газа сопровождается обжигом пирита(FeS) в печи «кипящего слоя», ответ 2.
Получение олеума происходит путем растворения оксида серы(SO3) в серной кислоте, сам процесс осуществляется в поглотительной башне, ответ 4.
Оксид серы(VI) получают в контактном аппарате с помощью каталитического окисления SO2, ответ 3.
Задание №3:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) стирол
Б) этиленгликоль
В) синтез-газ
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) производство маргарина
3) производство метанола
4) получение пластмасс
Решение:
Стирол(винилбензол) — это гомолог бензола, имеет формулу C6H5ꟷCH=CH2, за счет наличия кратной связи способен к реакциям полимеризации, в частности, в производстве пластмасс, ответ 4.
Этиленгликоль(1,2-этандиол) — это двухатомный спирт, который используется при получении полиэфиров, так как имеет две OH группы, которые потенциально могут вступать в реакцию поликонденсации с образованием полиэтилентерефталата (наши «любимые» пластиковые бутылки), ответ 1.
Синтез-газ(CO + H2) — довольно известная смесь угарного газа и водорода, используется при промышленном способе получения метилового спирта(метанола), ответ 3.
Задание №4:
Установите соответствие между веществом и способом его попадания в окружающую среду.
ВЕЩЕСТВО:
А) углекислый газ
Б) оксиды азота
В) гексахлоран
СПОСОБ ПОПАДАНИЯ В ОКРУЖАЮЩУЮ СРЕДУ:
1) сгорание углеводородного топлива
2) борьба с насекомыми
3) протравливание семян
4) сточные воды
Решение:
Углекислый газ и оксиды азота попадают в окружающую среду путем сгорания углеводородного топлива, А и Б ответ 1.
Гексахлоран используется в качестве инсектицида, ответ 2.
Задание №5:
Установите соответствие между названием процесса переработки нефти и его результатом.
НАЗВАНИЕ ПРОЦЕССА:
А) риформинг
Б) перегонка нефти
В) крекинг
РЕЗУЛЬТАТ:
1) разделение нефти на фракции
2) получение смазочных масел
3) увеличение количества легкокипящих фракций
4) получение ароматических углеводородов
Решение:
Риформинг — это процесс переработки алифатических углеводородов в ароматические(например, бензол), здесь подходит вариант 4.
Перегонка нефти приводит к разделению ее на фракции(лигроин, мазут, бензин), ответ 1.
Крекинг — это процесс высокотемпературного расщепления нефти с получением низкомолекулярных органических соединений, ответ 3.
Задание №6:
Установите соответствие между металлом и веществом, которое используется для получения этого металла в промышленности, или способом промышленного получения.
МЕТАЛЛ:
А) железо
Б) алюминий
В) натрий
ВЕЩЕСТВО /СПОСОБ ПОЛУЧЕНИЯ:
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
Решение:
Железо — в промышленности его получают из красного железняка, или гематита, который имеет формулу Fe2O3, ответ 1.
Алюминий можно получить электролизом Al2O3 в расплаве криолита, ответ 2.
Криолит, или гексафторалюминат натрия(Na3AlF6) — это необычный, редкий минерал, впервые обнаружен в Гренландии(отсюда название(криос — холод, литос — камень)), плавится при температуре 1012 С,
может растворять оксиды алюминия, что позволяет легко извлекать алюминий электролизом.
Натрий — для него здесь указано два возможных пункта, 3 и 4, однако, чистый Na можно получить только в РАСПЛАВЕ поваренной соли(NaCl), ответ 4.
Задание №7:
Установите соответствие между смесью веществ и способом разделения данной смеси.
СМЕСЬ ВЕЩЕСТВ:
А) вода и этиловый спирт
Б) вода и глина
В) вода и поташ
СПОСОБ РАЗДЕЛЕНИЯ:
1) фильтрование
2) выпаривание
3) использование делительной воронки
4) перегонка
Решение:
Первая смесь — вода и этиловый спирт, она может быть разделена перегонкой, ответ 4.
Следующая смесь — вода и глина, здесь нужно использовать фильтрование, ответ 1.
Последний ряд веществ — вода и поташ; поташ имеет формулу K2CO3, как и все соли калия, она растворима, и отделить ее от воды можно путем выпаривания, ответ 2.
Задание №8:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) изопропилбензол
Б) этанол
В) триолеин
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение ацетона
3) производство маргарина
4) получение дивинила
Решение:
Первое вещество — изопропилбензол, или кумол, оно используется для получения ацетона, ответ 2.
Второе соединение — этанол, который имеет важное значение для получения дивинила, или бутадиена-1,3(это реакция Лебедева, проведенная в 1926 году, давшая начало производству синтетического каучука), ответ 4.
Последнее вещество в списке — триолеин, составной частью этого химического соединения является «олеин», что означает принадлежность к жирам, а соответственно, к получению маргарина, ответ 3.
Задание №9:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) криолит
Б) пирит
В) метилметакрилат
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство антифриза
2) получение алюминия
3) производство серной кислоты
4) получение органического стекла
Решение:
Криолит(Na3AlF6) используется при получении чистого алюминия путем электролиза, ответ 2.
Пирит(FeS2) является начальной составной частью производства серной кислоты, ответ 3.
Метилметакрилат(метил-2-метилпроп-2-еноат) — это сложное органическое соединение, из которого получают органическое стекло, ответ 4.
Задание №10:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) глицерин
Б) формальдегид
В) глюкоза
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение взрывчатых веществ
3) хранение биологических препаратов
4) источник энергии в организме
Решение:
Глицерин, или 1,2,3 — пропантриол, это трехатомный спирт, который используется для получения нитроглицерина, являющегося составной частью взрывчатых веществ, ответ 2.
Формальдегид, или муравьиный альдегид, хорошо знаком биологам для сохранения биологических объектов в течение длительного времени, ответ 3.
Глюкоза(C6H12O6) — это моносахарид, который является источником АТФ(энергия) в организме живых существ, ответ 4.
Задание №11:
Установите соответствие между происхождением полимера и его названием.
ПРОИСХОЖДЕНИЕ ПОЛИМЕРА:
А) природный органический
Б) синтетический органический
В) искусственный органический
Название полимера:
1) сахароза
2) пенька
3) полиэфир
4) вискоза
Решение:
Природный органический полимер — из данного списка нам подходит пенька(грубое лубяное конопляное волокно), ответ 2.
Синтетический органический полимер из указанных веществ — полиэфир, ответ 3.
Искусственным органическим полимером является вискоза, ответ 4.
На сегодня все!
№ п/п
Вещество
Применение
1
Сера
Для получения серной кислоты, вулканизации каучука (производство резины), изготовления горючих и светящихся составов, в сельском хозяйстве и в медицине.
2
Соляная кислота
Пищевая добавка Е507, которая применяется в процессе изготовления водочной продукции, а так же различных сиропов. В металлургии для очистки металла перед паянием или лужением. Входит в состав чистящих средств.
3
Серная кислота
Очистка нефтепродуктов от сернистых, непредельных органических соединений; Удаление окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления различных металлических поверхностей перед покрытием их хромом, медью, никелем. Средство при получении красителей и лекарственных веществ, для производства удобрений, этилового спирта, искусственного волокна, анилиновых красителей.
4
Сероводород и сульфиды
В производстве серной кислоты, в медицине, для проведения химического анализа катионов.
5
Сернистый газ (SO2) и сульфиты
В производстве серной кислоты, получение бумаги, для отбеливания шелковых и шерстяных тканей, для уничтожения микроорганизмов и грибковых заболеваний (окуривание виноградников, подвалов, добавление в вино). Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве консервирующего агента.
6
Оксид серы (VI)
Для получения серной кислоты.
7
Соли серной кислоты
- Na2SO4 ∙ 10H2O (глауберова соль) – применяют в медицине в качестве слабительного средства, а безводный сульфат натрия – для производства соды и стекла.
- (NH4)2SO4 – азотное удобрение, K2SO4 – калийное удобрение.
- CaSO4 ∙ 2H2O (гипс) – в медицине и строительстве.
- MgSO4 (горькая соль) – в медицине в качестве слабительного средства.
- ВаSO4 (баритовая каша) – в медицине как рентгеноконтрастное вещество.
- Купоросы: CuSO4 ∙ 5H2O – используют для протравливания семян, для борьбы с болезнями растений; FeSO4 ∙ 7H2O – для приготовления чернил, минеральных красок; ZnSO4 ∙ 7H2O – для производства минеральных красок и в медицине (как антисептик).
8
Азот
Жидкий азот применяется для глубокого охлаждения, газообразный – для синтеза аммиака, для создания инертной атмосферы (лампы накаливания, сварка).
9
Азотная кислота
Производство азотных и комбинированных удобрений (натриевой, аммиачной, кальциевой и калиевой селитры, нитрофоса, нитрофоски). Взрывчатые вещества (тринитротолуола и др.), органических красителей. В металлургии — для растворения и травления металлов, а также для разделения золота и серебра.
10
Аммиак
Производство азотной кислоты, которая идет на производство удобрений (аммиачная селитра NH4NO3, мочевины (NH2)2CO, аммофос – смесь гидрофосфата (NH4)2HPO4 и дигидрофосфата аммония NH4H2PO4). В качестве дешевого хладагента в промышленных холодильных установках. Для получения синтетических волокон, например, найлона и капрона. При очистке и окрашивании хлопка, шерсти и шелка. Водный раствор аммиака (нашатырь) – в медицине.
11
Соли аммония
Производство взрывчатых веществ в смеси с порошками алюминия и угля при горных разработках, в качестве удобрений, при пайке металлов.
12
Оксиды азота
N2O – в медицине (наркоз), NO2 – производство азотной кислоты.
13
Водород
Экологически чистое топливо, для сварки и резки металлов, для получения металлов, аммиака, метанола, хлороводорода, гидрирования жидких жиров (в производстве маргарина).
14
Кислород
Реагент в органическом и неорганическом синтезе, для обеспечения дыхания в медицине.
15
Фосфор
Производство фосфорных удобрений (фосфоритной муки, простых и двойных суперфосфатов, комплексных азотно-фосфорных удобрений). Производство синтетических моющих средств, фосфатных стёкол, для обработки и крашения натуральных и синтетических волокон.
16
Оксид фосфора (V)
Получение ортофосфорной кислоты, в качестве осушителя (поглощает воду)
17
Ортофосфорная кислота
Производство фосфорных удобрений, в органическом синтезе.
18
Галогены
- Фтор — для получения смазочных веществ, выдерживающих высокую температуру, тефлона, фреонов и т.д.
- Хлор – в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, для отбеливания тканей и целлюлозы, идущей на изготовление бумаги, для стерилизации питьевой воды и обеззараживания сточных вод, полимеров.
- Бром — выработка различных лекарственных веществ, расителей, а также бромида серебра, использующегося в производстве фотоматериалов.
- Йод — в медицине в виде 10%-го раствора в этаноле в качестве антисептического и кровоостанавливающего средства. Йод входит в состав ряда фармацевтических препаратов.
19
Хлориды
- NaCl – для получения хлороводорода, натрия, хлора, едкого натра, водорода, в производстве соды, в пищевой промышленности медицине.
- KCl – в качестве калийного удобрения.
- ZnCl2 – для пропитки древесины от гниения и при пайке металлов, в медицине в качестве антисептика.
- BaCl2 — для борьбы с вредителями растений.
- CaCl2 — в качестве осушителя и в медицине.
- AlCl3 – катализатор в органическом синтезе.
- HgCl2 – для протравливания семян, дубления кожи в органическом синтезе.
20
Углерод
Алмазы применяются для обработки твёрдых материалов (бурение горных пород, металлообрабатывающий инструмент) в ювелирной промышленности (производство бриллиантов). Графит используется в производстве карандашей и электродов. Уголь и кокс используют в качестве топлива и для получения металлов, активированный уголь является адсорбентом.
21
Угарный газ
В качестве топлива, при получении метанола, металлов, фосгена (COCl2), в органическом синтезе.
22
Углекислый газ
В производстве напитков, соды, сахара, в огнетушителях, для хранения скоропортящихся продуктов («сухой лёд»), для получения угарного газа и участвует в процессе фотосинтеза.
23
Соли угольной кислоты
- Na2CO3 – кальцинированная сода и Na2CO3 ∙ 10Н2О – кристаллическая сода применяются в производстве бумаги, стекла, мыла, в быту.
- NaHCO3 – гидрокарбонат натрия (питьевая сода, двууглекислая сода) применяется в медицине, в пищевой и кондитерской промышленности.
- K2CO3 – поташ, применяется для производства мыла и специальных сортов стекла, в химической промышленности.
- CaCO3 – применяется для получения негашеной извести CaO, в строительстве, в архитектуре, для изготовления скульптур.
24
Кремний
Для получения легированных сталей, производства полупроводниковых приборов и изготовления кислотоустойчивой аппаратуры.
25
Оксид кремния (IV)
При производстве стекла, цемента, в строительстве, в производстве керамических изделий, химической посуды.
26
Натрий и калий
Получение пероксидов и амидов, сплав этих металлов используется в качестве теплоносителей в ядерных реакторах.
27
Бериллий
Получение сплавов
28
Медь
Для изготовления электропроводов и сплавов – бронзы, латуни, дюралюминия.
29
Серебро
Компонентов сплавов ювелирных изделий, монет, медалей, столовой и лабораторной посуды, для серебрения зеркал, как катализатор в органическом синтезе.
30
Цинк
Получение сплавов, для цинкования стали и чугуна в антикоррозионных целях.
31
Хром
Компонент стали (хромированная сталь), изготовление инструментов.
32
Железо
В качестве катализатора (губчатое железо), производство чугуна и сталей.
33
Алюминий
Используется для изготовления различных сплавов, применяемых в авиационной, машиностроительной, пищевой и электротехнической промышленности; для получения металлов методом алюмотермии (Cr, Mn, V, Ti и др.)
34
Ртуть
Производство люминесцентных и ртутных ламп, контрольно-измерительных приборов (термометров, манометров, барометров и т.д.), в медицине для изготовления мазей для лечения кожных заболеваний.
35
Гидроксид натрия
NaOH (едкий натр, каустическая сода, каустик) применяют для очистки нефтепродуктов, в производстве мыла, бумаги, в текстильной и химической промышленности.
36
Гидроксид кальция
В строительстве, производстве стекла, смягчитель воды.
37
Гидроксид магния
Очистка сахарных растворов, входит в состав зубной пасты.
38
Гидроксид алюминия
Для очистки воды, в медицине как обволакивающее и адсорбирующее вещество.
39
Алканы (метан, пропан)
В качестве топлива, как растворители и как сырьё для получения органических веществ.
40
Алкены (изопрен, этилен, пропилен)
Получение полимеров, фенола, ацетона, ацетальдегида, растворителей; для улучшения детонационных качеств топлива. Этилен – для ускорения созревания плодов растений.
41
Алкины
Ацетилен используется для резки и сварки металлов, в органическом синтезе: в производстве синтетических каучуков, поливинилхлорида, уксусной кислоты и растворителей.
42
Алкадиены
Производство полимеров (каучуков).
43
Бензол и его производные
Получение красителей, лекарственных веществ, взрывчатых веществ, ядохимикатов, пластмасс и синтетических волокон; используются в качестве растворителей; добавляются в бензины, повышая их октановое число.
44
Спирты
В качестве растворителей и в органическом синтезе. Этанол применяется для изготовления спиртных напитков, в медицине как дезинфицирующее средство, в качестве топлива. В промышленности – растворитель в производстве каучука, сложных эфиров, лаков, медикаментов. Метанол применяют для получения формальдегида, растворителей, в органическом синтезе.
45
Многоатомные спирты
Этиленгликоль применяется для приготовления охлаждающей жидкости (антифризов) для автомобилей, для получения растворителей и взрывчатых веществ. Глицерин – используется в медицине, парфюмерии, кожевенной промышленности, для получения взрывчатого вещества (тринитроглицерин), лакокрасочных материалов.
46
Фенолы
Применяют для получения фенолформальдегидной смолы, взрывчатых веществ, красителей, лекарственных препаратов, капрона, для дезинфекции (карболка).
47
Альдегиды и кетоны
Формальдегид – используется для получения фенолформальдегидной и карбамидной смол, в органическом синтезе; 40%-ный раствор (формалин) применяется в медицине, для консервирования биологических препаратов, в кожевенной промышленности и для протравливания семян.
Ацетальдегид – применяется для получения уксусной кислоты и для синтеза различных органических веществ.
Ацетон – в качестве растворителя лаков, красок.
48
Карбоновые кислоты
Муравьиная кислота – 1,25% -ный спиртовой раствор (муравьиный спирт) применяется в медицине, для производства сложных эфиров.
Уксусная кислота – в пищевой промышленности, для производства красителей, лекарств (аспирин), сложных эфиров, ацетатного волокна.
Стеариновая C17H35COOH и пальмитиновая C17H33COOH кислоты – входят в состав жиров. Натриевая и калиевая соли входят в состав мыла.
Щавелевая кислота – используется в кожевенной и текстильной промышленности.
Акриловая и метакриловая кислоты – для получения полимеров (органического стекла), волокон.
Бензойная кислота – в качестве консерванта в пищевой промышленности.
49
Сложные эфиры
Применяются в качестве растворителей лакокрасочных материалов, в парфюмерии, при производстве напитков.
50
Жиры
Жиры применяются в качестве продукта питания, для получения мыла, в косметической и фармацевтической промышленности. Гидрированные жиры применяются для изготовления маргарина.
51
Целлюлоза
Нитраты целлюлозы используются для производства бездымного пороха и лаков, ацетаты – в производстве ацетатного волокна, лаков, плёнок. Целлюлоза используется в производстве бумаги, волокон (ацетатного и вискозного), одежды, бинтов, ваты
52
Крахмал
Применяется для получения клея (декстриновый клей), накрахмаливания белья, в кондитерском производстве (получение патоки), в производстве спирта и вина.
53
Амины
Анилин и другие ароматические амины используются для получения красителей, лекарственных и взрывчатых веществ. Алифатические амины используются для получения лекарственных препаратов, пестицидов и пластмасс.
|
Элемент и его соединения |
Применение |
|
Ø Al Ø Al₂O₃ Ø AlCl₃ Ø Al₂(SO₄)₃ ∙ 18H₂O |
· Алюмотермия используется в металлургии для получения металлов: 2Al + Fe₂O₃ = 2Fe + Al₂O₃ · Машиностроение, авиастроение, судостроение · Алюминиевая посуда · Некоторые соли применяются в медицине для лечения кожных заболеваний · Адсорбент в хроматографии · Катализатор в органической химии · Очистка воды |
|
Ø Fe Ø FeCl₃ Ø Fe(NO₃)₃ |
· Сплавы железа являются основным конструкционным материалом · Катализатор в органической химии · Окраска тканей |
|
Ø Cr Ø «Хромовая смесь» — раствор K₂Cr₂O₇ вH₂SO₄(конц) |
· В металлургии для получения специальных сортов стали · Хромом покрывают другие металлы с целью предохранения их от коррозии · Окислитель для очистки стеклянной химической посуды |
|
Ø KMnO₄ |
· Дезинфицирующее средство |
|
Ø Cu |
· Соединения меди используются для борьбы с вредителями сельскохозяйственных растений |
|
Ø H₂ Ø H₂O₂ |
· Сырьё для получения NH₃, HCl, CH₃OH · В пищевой промышленности водород используют для выработки твёрдых жиров путём гидрогенизации растительных масел · В металлургии для восстановления некоторых металлов и оксидов · Летательные аппараты, воздушные шары, зонды наполняют водородом · «водородная горелка» для сварки и резки металлов · Жидкий водород – одно из наиболее эффективных видов ракетного топлива · В энергетике водород используют в качестве топлива · Дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство |
|
Ø Cl₂ |
· В производстве пластмасс · Отбеливатель бумаги и тканей · Обеззараживание воды – «хлорирование» · В химической промышленности для получения соляной кислоты, фосгена, хлорной извести, хлороформа, моющих средств, ядохимикатов, каучуков |
|
Ø O₂ |
· В металлургии при выплавке чугуна и стали · В смеси с ацетиленом используют для сварки и резки металлов · В химической промышленности · В медицине (кислородные подушки, кислородные коктейли и др.) |
|
Ø S Ø H₂S Ø SO₂ Ø H₂SO₄ Ø MgSO₄ ∙ 7H₂O(горькая английская соль)и Na₂SO₄ ∙ 10H₂O(глауберова соль) Ø CaSO₄ ∙ 2H₂O |
· Широко применяется для борьбы с вредителями сельского хозяйства · Для вулканизации каучука · В производстве спичек, пороха · В медицине для лечения кожных заболеваний · В медицине для лечения ревматизма и кожных заболеваний · Сероводород – один из компонентов минеральных вод · В текстильной промышленности для отбеливания различных изделий · Для уничтожения вредных микроорганизмов · Получение серной кислоты · Осушка газов · Получение других кислот · Получение удобрений · Различные красители · Слабительное · Гипсовые повязки |
|
Ø N₂ Ø NH₃ Ø NH₄OH(нашатырный спирт) и NH₄Cl Ø Аммонийные соли Ø N₂O(веселящий газ) Ø HNO₃ |
· Исходное сырьё для получения аммиака, азотной кислоты, азотных удобрений · Получение азотной кислоты, гидроксида аммония и т.д. · В медицине · Удобрения · В медицине для наркоза · Для получения удобрений, лекарственных и взрывчатых веществ |
|
Ø P Ø H₃PO₄ |
· Производство фосфорной кислоты · Красный фосфор используется при изготовлении спичек · Производство удобрений · Изготовление реактивов, многих органических веществ, для получения катализаторов · Для создания защитных покрытий на металлах · В фармацевтической промышленности |
|
Ø C Ø CO Ø CO₂ Ø Na₂CO₃ |
· Алмаз применяется в промышленности для обработки твердых сплавов и бурения, также для изготовления ювелирных изделий · Графит применяется в электротехнике для изготовления электродов · В металлургии для получения металлов и руд · Пищевая промышленность (газированная вода, лимонады) · Сухой лёд · Пищевая промышленность (сода) |
|
Ø Si Ø SiO₂ |
· Получение полупроводниковых материалов и сплавов · Из сплава кремния с железом (ферросилиций) изготавливают химическую аппаратуру · Сырьё для производства стекла · Изготовление цемента |
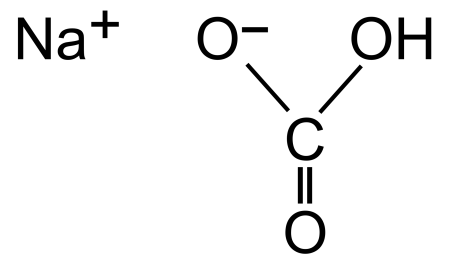
| Гидрокарбонат натрия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES |
[Na+].OC([O-])=O |
| InChI |
1S/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 UIIMBOGNXHQVGW-UHFFFAOYSA-M |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Содержание
- 1 Химические свойства
- 1.1 Реакция с кислотами
- 2 Термическое разложение
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В кулинарии
- 4.3 В медицине
- 4.3.1 Противопоказания к применению в медицинских целях
- 4.4 Пожаротушение
- 4.5 В быту
- 4.6 В транспорте
- 5 Производство
- 6 Хранение
- 7 Безопасность
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3 + HCl → NaCl + H2CO3
- H2CO3 → H2O + CO2↑
- 2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2↑
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
- 2NaHCO3 →60−200∘C Na2CO3 + H2O + CO2↑
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- NH3 + CO2 + H2O → NH4HCO3
- NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl—, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3.
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.


