Транспорт газов. Прочти меня
Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема.
Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
Утилизация кислорода тканями
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Транспорт СО2
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Анион бикарбоната составляет около 90% от общего содержания СО2 в артериальной крови: СО2+Н2О – Н++НСО-3.
Эта реакция медленно протекает в плазме крови, но чрезвычайно интенсивно происходит в эритроцитах при участии фермента карбоангидразы. Мембрана эритроцита относительно непроницаема для Н+, как и вообще для катионов, но в тоже время, проницаема для ионов НСО-3, выход которых из эритроцитов в плазму обеспечивается притоком Cl- из плазмы в эритроциты. Часть Н+ забуферивается гемоглобином с образованием восстановленного гемоглобина.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином (корбогемоглобин):
Hb NH2 + CO2 – Hb NH COOH > Hb NH COO + Н+
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
Связывание гемоглобина с окисью углерода
Угарный газ (СО) – окись углерода обладает значительно большим сродством к гемоглобину, чем О2, с последующим образованием карбоксигемоглобина. СО входит в состав бытового газа, а также выделяется при работе двигателей внутреннего сгорания. При концентрации СО во вдыхаемом воздухе всего в количестве 7*10- 4 около 50% гемоглобина превращается в карбоксигемоглобин. В норме в крови содержится около 1% HbCO, у курильщиков – 3% . В крови водителей такси концентрация карбоксигемоглобина достигает 20%. Карбоксигемоглобин диссоциирует с отдачей О2 в 200 раз медленней оксигемоглобина и в то же время препятствует его диссоциации в тканях.
Источник – ЛЕКЦИЯ 4 ФИЗИОЛОГИЯ ТРАНСПОРТА ГАЗОВ КРОВЬЮ И КИСЛОРОДНОГО ОБЕСПЕЧЕНИЯ ТКАНЕЙ – Научное обозрение. Медицинские науки (научный журнал) (science-medicine.ru)
Гемоглобин крови, соединяясь с кислородом, транспортирует его из органов дыхания в остальные органы. В зависимости от строения молекулы гемоглобин может иметь разную степень сродства к кислороду. Чем выше сродство гемоглобина к кислороду, тем хуже происходит диффузия кислорода из крови в ткани. У каких животных сродство гемоглобина к кислороду будет ниже — у крупных копытных млекопитающих или у мелких грызунов? Ответ поясните.
Спрятать пояснение
Пояснение.
1. Сродство гемоглобина к кислороду будет ниже у мелких грызунов.
2. У мелких животных интенсивность метаболизма (обмена веществ) выше, чем у крупных.
3. Низкое сродство гемоглобина мелких грызунов к кислороду позволяет им эффективнее отдавать кислород в тканях.
4. Высокое содержание кислорода в тканях будет обеспечивать интенсивный метаболизм.
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ включает в себя все названные выше элементы, не содержит биологических ошибок | 3 |
| Ответ включает в себя два из названных выше элементов и не содержит биологических ошибок, ИЛИ ответ включает в себя три названных выше элемента, но отсутствуют пояснения | 2 |
| Ответ включает в себя один из названных выше элементов и не содержит биологических ошибок, ИЛИ ответ включает в себя два из названных выше элементов, но отсутствуют пояснения | 1 |
| Ответ включает только один из названных выше элементов и содержит биологические ошибки, ИЛИ ответ неправильный | 0 |
| Максимальный балл | 3 |
Источник: ЕГЭ по биологии 14.06.2022. Основная волна. Разные задачи
Задания с развернутым ответом
Линия вопросов 25-26
(Приведены задания реального ЕГЭ 2022)
За последние десятилетия многие южные инфекции, переносимые насекомыми и клещами, продвинулись в северные регионы, где раньше они не встречались. Ученые предполагают, что это явление связано с увеличением в атмосфере концентрации парниковых газов. Дайте объяснение наблюдаемой закономерности. Почему у людей, живущих в новых для инфекции ареалах, течение болезни происходит тяжелее, а распространение — быстрее, чем у жителей южных регионов, откуда началось распространение болезни?
1) увеличение концентрации парниковых газов в атмосфере приводит к потеплению климата на планете;
2) температура в северных регионах становится подходящей для распространения переносчиков инфекций (насекомых и клещей);
3) увеличивается срок сезонной активности у переносчиков инфекций;
4) у жителей северных регионов отсутствует иммунитет к новой для этих регионов инфекции.
Какие приспособления в строении и поведении костных рыб обеспечивают интенсивное извлечение ими кислорода из воды? Объясните адаптивное значение каждого приспособления.
1) большая площадь поверхности жабр обеспечивает большой контакт с водой;
2) многочисленные капилляры в жабрах обеспечивают максимальное извлечение кислорода из воды;
3) движение жаберных крышек обеспечивает движение воды, омывающей жабры;
4) плавание с открытым ртом (увеличение скорости движения) обеспечивает усиление омывания жабр водой;
5) противоточное движение крови в капиллярах и воды в жабрах (в противоположных направлениях) обеспечивает максимальное извлечение кислорода из воды.
Кактусы относятся к группе растений-суккулентов. Какое адаптивное значение имеют такие особенности строения кактусов, как шаровидная форма стебля и глубоко погруженные в ткань стебля устьица? Почему у кактусов развивается поверхностная корневая система?
1) шаровидная форма имеет наименьшую площадь поверхности;
2) растение меньше теряет воду (меньше транспирация, испарение);
3) погруженные устьица препятствуют избыточному испарению (транспирации);
4) поверхностная корневая система позволяет собирать влагу с верхнего слоя почвы (от росы и дождей).
При намокании у собаки шерсти происходит реакция отряхивания. Собаку в течение месяца во время кормления поливали холодной водой. У собаки выработался рефлекс: во время кормления она отряхивалась, даже если её не поливали водой. Через две недели рефлекс отряхивания пропал. Какой рефлекс выработался у собаки? Какие нервные центры участвовали в осуществлении этих рефлексов? Почему через две недели рефлекс пропал?
1) отряхивание при намокании шерсти – безусловный рефлекс;
2) отряхивание после подачи пищи (после отмены обливания) – условный рефлекс;
3) центр безусловного рефлекса расположен в среднем мозге (стволе головного мозга, спинном мозге);
4) центр условного рефлекса расположен в коре больших полушарий;
5) реакция отряхивания у собаки исчезла, т.к. произошло торможение (условное, внутреннее)
ИЛИ не было подкрепления условного рефлекса.
Снегири и некоторые виды синиц являются оседлыми птицами, зимующими в местах гнездования. Какое адаптивное значение в зимний период имеют такие особенности поведения этих птиц, как частое распущение перьев («нахохливание»), дрожание, частое питание, кочевки?
1) при нахохливании образуется теплоизолирующая воздушная прослойка между перьями;
2) дрожание способствует выработке тепла при сокращении мышц;
3) частое питание покрывает затраты энергии на терморегуляцию;
4) качевки позволяют перемещаться в места, где больше корма (обеспечивают избегание мест с наиболее сильными морозами).
Как расположены глаза у крупных хищных и травоядных млекопитающих? В чем преимущество такого расположения глаз у этих групп животных?
1) у хищных млекопитающих глаза расположены спереди (во фронтальной плоскости);
2) у травоядных млекопитающих глаза расположены по бокам головы;
3) расположение глаз у хищников обеспечивает объемное (бинокулярное) зрение;
4) расположение глаз у хищников позволяет точно определить расстояние до жертвы;
5) расположение глаз у травоядных обеспечивает широкий угол обзора;
6) расположение глаз у травоядных обеспечивает возможность видеть приближение хищников с разных сторон.
Известно, что у морских водорослей концентрация органических веществ (сахаров, спиртов и аминокислот) в цитоплазме клеток существенно выше, чем у пресноводных водорослей. Как можно объяснить такое биохимическое отличие морских водорослей от пресноводных? Почему эти соединения зачастую не являются источниками для процессов энергетического и пластического обмена веществ в клетках?
1) в морской воде концентрация солей выше, чем в пресной воде (осмотическое давление в морской воде выше);
2) вода стремится выйти из клеток водорослей во внешнюю среду (осмос направлен в сторону гипертонического раствора);
3) чтобы компенсировать осмотическое давление среды (предотвратить отток воды), морские водоросли накапливают органические вещества (осмотически активные вещества);
4) при расходовании таких веществ нарушился бы гомеостаз (осмотический баланс)
Использование инсектицидов в период цветения луговых растений в течение нескольких лет привело к сокращению численности насекомых-опылителей. Как изменится численность других видов организмов в экосистеме луга? Приведите четыре изменения.
1) сокращение численности насекомоопыляемых растений (сокращение численности паразитов насекомых и насекомоопыляемых растений);
2) сокращение численности растительноядных животных, питающихся этими растениями;
3) сокращение численности насекомоядных животных (и животных следующих трофических уровней);
4) увеличение численности ветроопыляемых растений
Млекопитающие не способны синтезировать ферменты, расщепляющие целлюлозу (клетчатку). При этом многие виды млекопитающих питаются растительной пищей. Какие адаптации в строении пищеварительной системы существуют у травоядных млекопитающих для питания травой? Укажите четыре адаптации и поясните значение каждой из них.
1) специальная форма зубов (острые резцы), развиты коренные зубы;
2) служат для откусывания (перетирания) травы (веток, коры);
3) желудок может иметь несколько камер (сложное строение);
4) в желудке идёт бактериальная обработка травы (сбраживание) и механическая обработка;
5) тонкая кишка длинная;
6) увеличивает время переваривания (всасывания пищи);
7) слепая кишка хорошо развита (длинная);

В зависимости от строения своей молекулы дыхательный белок гемоглобин может иметь различную степень сродства к кислороду, то есть различную способность присоединять кислород к железосодержащему гему. Чем меньше сродство гемоглобина к кислороду, тем медленнее кровь связывает кислород из внешней среды. Как различается сродство гемоглобина к кислороду у высокогорных лам, в отличие от верблюдов, обитающих в степях Монголии? Ответ аргументируйте. Какие параметры форменных элементов крови обеспечивают её кислородную ёмкость (способность насыщаться кислородом) у различных групп позвоночных животных?
1) сродство гемоглобина к кислороду больше у высокогорных лам (меньше у верблюдов);
2) концентрация кислорода (парциальное давление) в условиях высокогорья ниже, чем в степях Монголии (концентрация кислорода в степях Монголии выше, чем в условиях высокогорья);
3) количество эритроцитов;
4) наличие или отсутствие ядра в эритроцитах (форма эритроцитов);
5) размер эритроцитов;
6) количество (концентрация) гемоглобина (в эритроцитах).
Ещё статьи…
- Для истинных наземных животных (амниот) характерен прямой тип постэмбрионального развития
- Известно, что у прибрежных водорослей, обитающих в арктических морях, концентрация органических веществ
- По данным исследователей, в арктических почвах в большом количестве обитают представители нескольких групп цианобактерий
Плацентарная недостаточность — это одно из наиболее распространённых осложнений беременности. Под плацентарной недостаточностью подразумевают нарушение функций плаценты, возникающее под воздействием различных факторов. Такое нарушение может приводить к серьёзным последствиям. К каким последствиям может привести нарушение функций плаценты? Какие признаки плода могут указывать на наличие этой патологии
1) Нарушение функций плаценты приводит к кислородному голоданию тканей (гипоксии), влечет нарушение развития органов и тканей плода, задержку внутриутробного развития вплоть до гибели.
2) К признакам плацентарной недостаточности относятся: снижение двигательной активности плода, отставание размеров и массы плода от срока беременности.
Найдите ошибки в приведенном тексте. Укажите номера предложений, в которых сделаны ошибки, исправьте их.
1. Процесс образования первичной мочи происходит за счет фильтрации плазмы крови в собирательных трубочках нефронов. 2. Первичная моча отличается от плазмы крови отсутствием в ней молекул углеводов. 3. В сутки образуется приблизительно 150 литров первичной мочи. 4. Вторичная моча образуется путем обратного всасывания. 5. В капилляры, оплетающие капсулу нефрона, поступают вещества из первичной мочи.
1) Гемоглобин — белок, содержащийся в эритроцитах, придает красный цвет крови. Гемоглобин состоит из органической (белковой части) — глобина и неорганического компонента (железосодержащего) — гема.
2) За счет гемоглобина, который соединен с кислородом, — оксигемоглобина, артериальная кровь имеет ярко-красный цвет.
3) За счет гемоглобина, который соединен с углекислым газом, — карбогемоглобина, венозная кровь имеет тёмно-красный цвет.
1) Растворимость кислорода в воде (в плазме) очень низкая.
2) Кислород для транспорта его кровью связывается с гемоглобином.
3) Гемоглобин содержится в эритроцитах крови.
4) Кислород, соединяясь с гемоглобином, изменяет цвет крови с темно-красного (венозная) на алый (артериальная).
5) Ион железа соединяется с кислородом.
6) Железо окисляется (ион железа +2 превращается в ион железа +3).
Гемоглобин крови, соединяясь с кислородом, транспортирует его из органов дыхания в остальные органы. В зависимости от строения молекулы гемоглобин может иметь разную степень сродства к кислороду. Чем выше сродство гемоглобина к кислороду, тем хуже происходит диффузия кислорода из крови в ткани. У каких животных сродство гемоглобина к кислороду будет ниже — у крупных копытных млекопитающих или у мелких грызунов? Ответ поясните.
1) Сродство гемоглобина к кислороду будет ниже у мелких грызунов.
2) У мелких животных интенсивность метаболизма (обмена веществ) выше, чем у крупных.
3) Низкое сродство гемоглобина мелких грызунов к кислороду позволяет им эффективнее отдавать кислород в тканях.
4) Высокое содержание кислорода в тканях будет обеспечивать интенсивный метаболизм.
1) У резус-отрицательной матери и резус-положительного отца может получиться резус-положительный ребенок.
2) Возможен резус-конфликт. Через плаценту в кровь женщины поступает чужеродный белок, на который вырабатываются антитела.
3) Во время второй беременности (второй беременности резус-положительным плодом) эти антитела могут сработать против ребенка: вызвать осложнения беременности, вплоть до ее прерывания, и гемолитическую болезнь новорожденных.
Внутренняя среда организма складывается из 3 тесно взаимосвязанных компонентов: кровь, лимфа и межклеточная жидкость (тканевая,
интерстициальная).
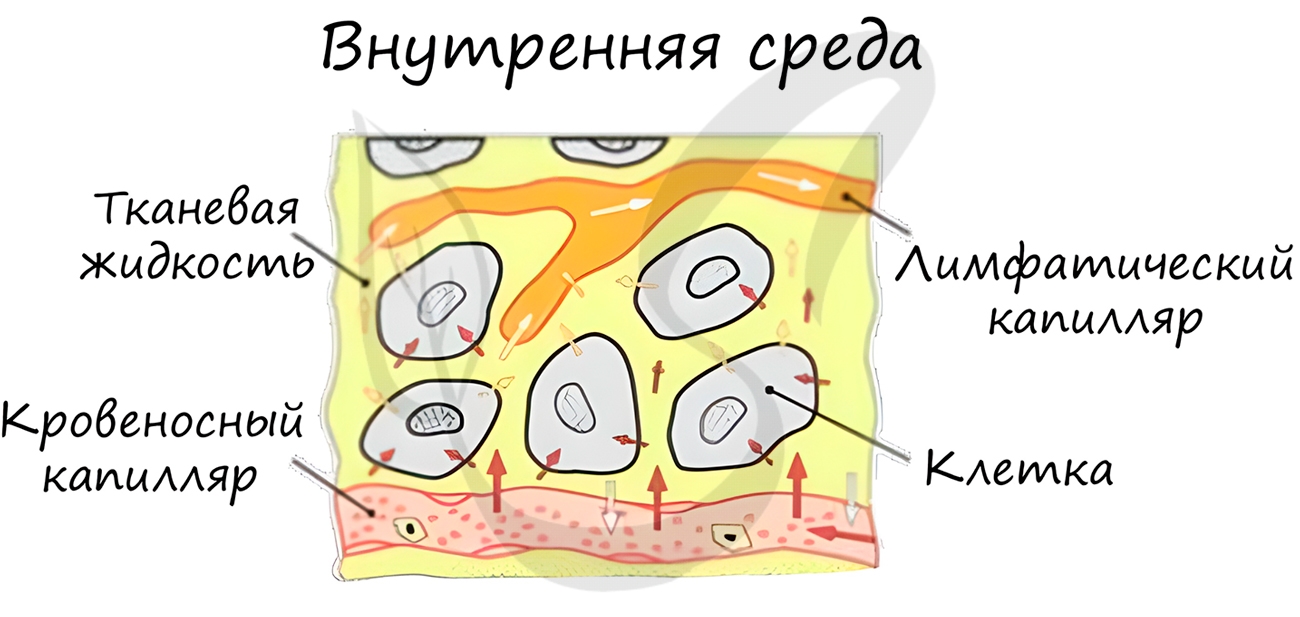
В капиллярах стенка состоит из одного слоя клеток, что делает возможным газообмен и обмен питательными веществами с окружающими капилляр тканями. Через стенку
сосуда газы, питательные вещества и вода из крови устремляются к клеткам. В клетках происходит тканевое дыхание, в межклеточную
жидкость выделяется углекислый газ, который затем поступает в кровь, соединяется с гемоглобином и, достигая альвеол в легких,
удаляется из организма.
У лимфатических сосудов есть особенность, которую вы всегда обнаружите на рисунке: они начинаются слепо, в отличие от кровеносных
сосудов. Лимфу в них образует вода, поступающая из межклеточной жидкости. Лимфа участвует в перераспределении жидкости в организме.
Состав и функции крови
Кровь — важнейшая составляющая внутренней среды организма. Напомню, что эта ткань относится к жидким соединительным
тканям и состоит из плазмы (на 55%) и форменных элементов (оставшиеся 45%). У взрослого человека объем крови составляет 4-6 литра.
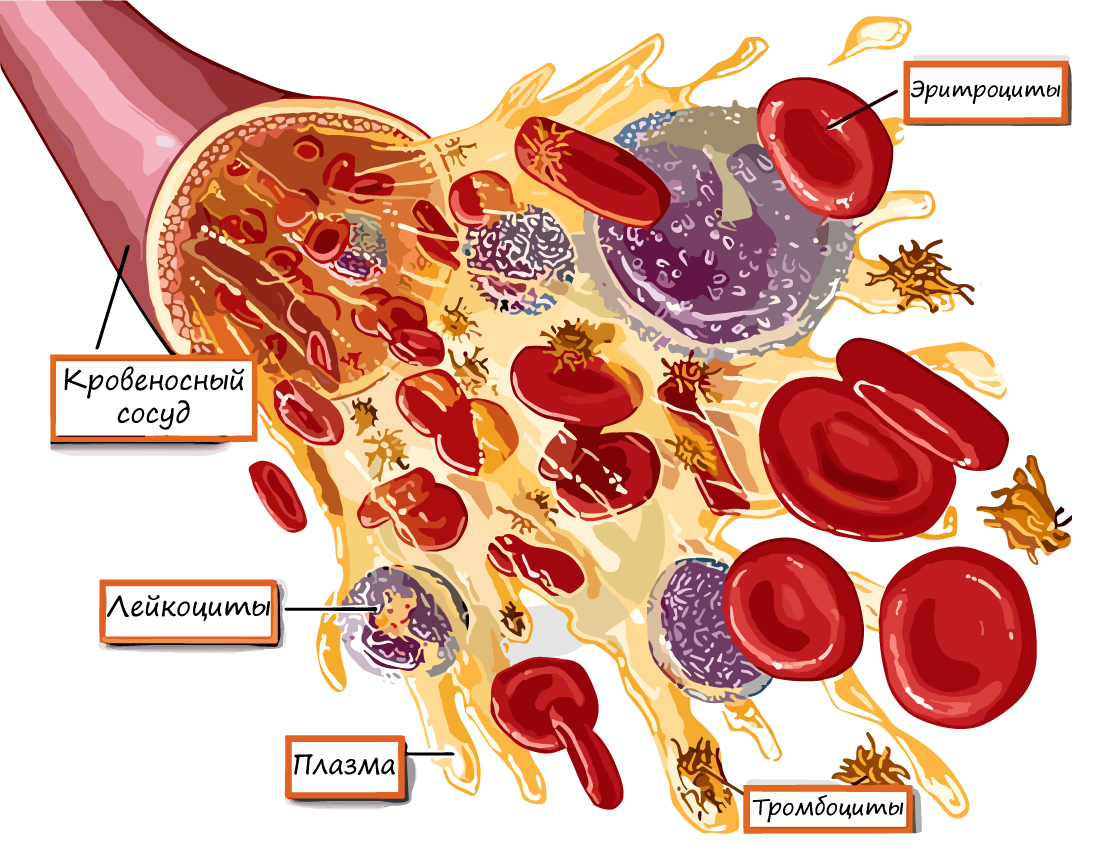
Давайте систематизируем и углубим наши знания о крови. Кровь состоит из:
- Плазмы на 55%
- Трофическую (питательную) — белки плазмы являются источником аминокислот
- Буферную — поддерживают кислотно-щелочное состояние (pH крови = 7,35-7,4)
- Транспортную — белки глобулины транспортируют питательные вещества — жиры, а также гормоны, витамины
- Защитную — в крови циркулируют антитела, белки крови (в частности фибриноген) обеспечивают гемостаз
(свертывание крови) - Форменных элементов
- Эритроциты — от греч. ἐρυθρός — красный и κύτος — вместилище, клетка
- C кислородом — оксигемоглобин
- C углекислым газом — карбгемоглобин
- C угарным газом — карбоксигемоглобин
- Лейкоциты — от др.-греч. λευκός — белый и κύτος — вместилище, тело
- Осуществлении фагоцитоза
- Обезвреживании ядов, токсинов
- Участие в клеточном и гуморальном иммунитете
- Тромбоциты — от греч. θρόμβος — сгусток и κύτος — клетка
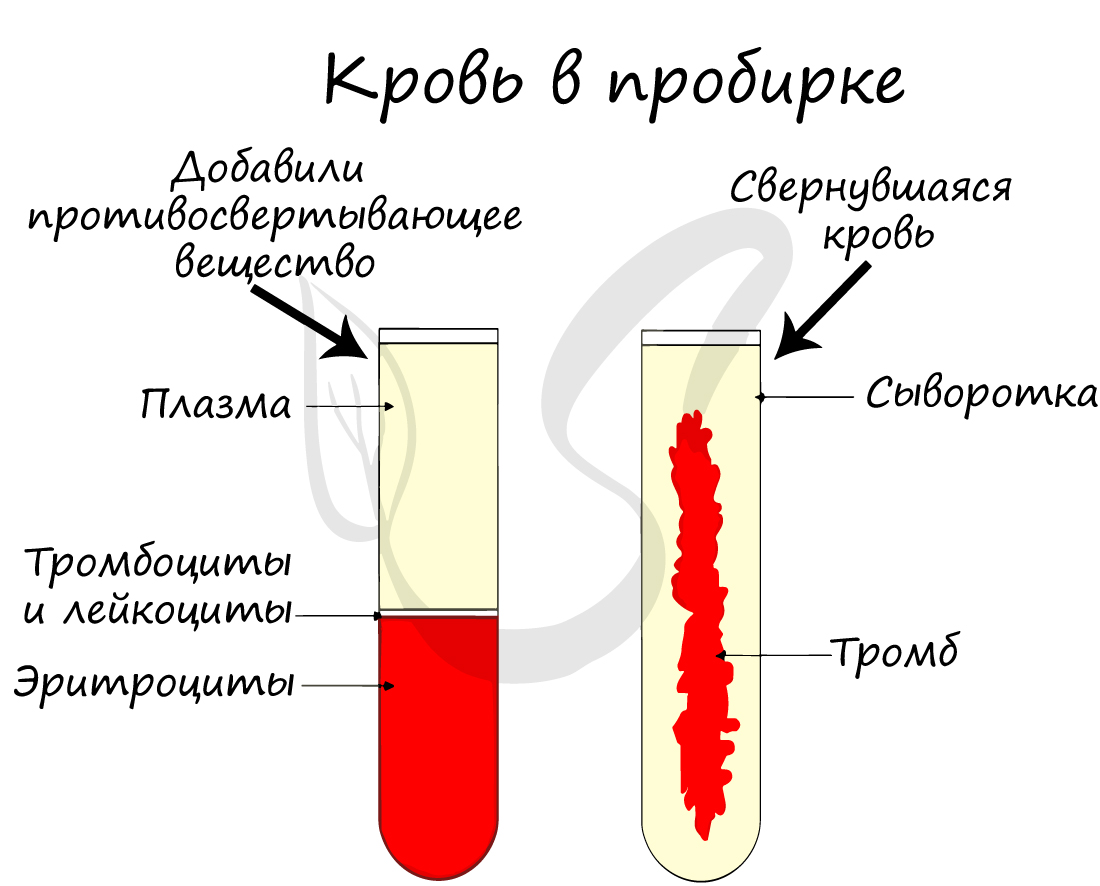
В состав плазмы входят различные белки: альбумины, глобулины, фибриноген, ионы Ca2+, K+,
Mg2+, Na+, Cl—, HPO42-, HCO3—.
Плазма выполняет ряд важных функций:
Отметьте, что плазма крови без фибриногена называется сывороткой (она не свертывается, в отличие от плазмы).
Концентрация соли NaCl (хлорида натрия) в крови примерно постоянна и составляет 0,9%.
К ним относятся:
Эритроциты — красные кровяные тельца, основная их
функция — дыхательная — перенос газов: кислорода от альвеол легких к тканям и углекислого газа от тканей к альвеолам.
В 1 мм3 крови находится около 4-5 млн.
Основной белок эритроцита — гемоглобин, состоящий из железосодержащего гема (Fe) и белка глобина.
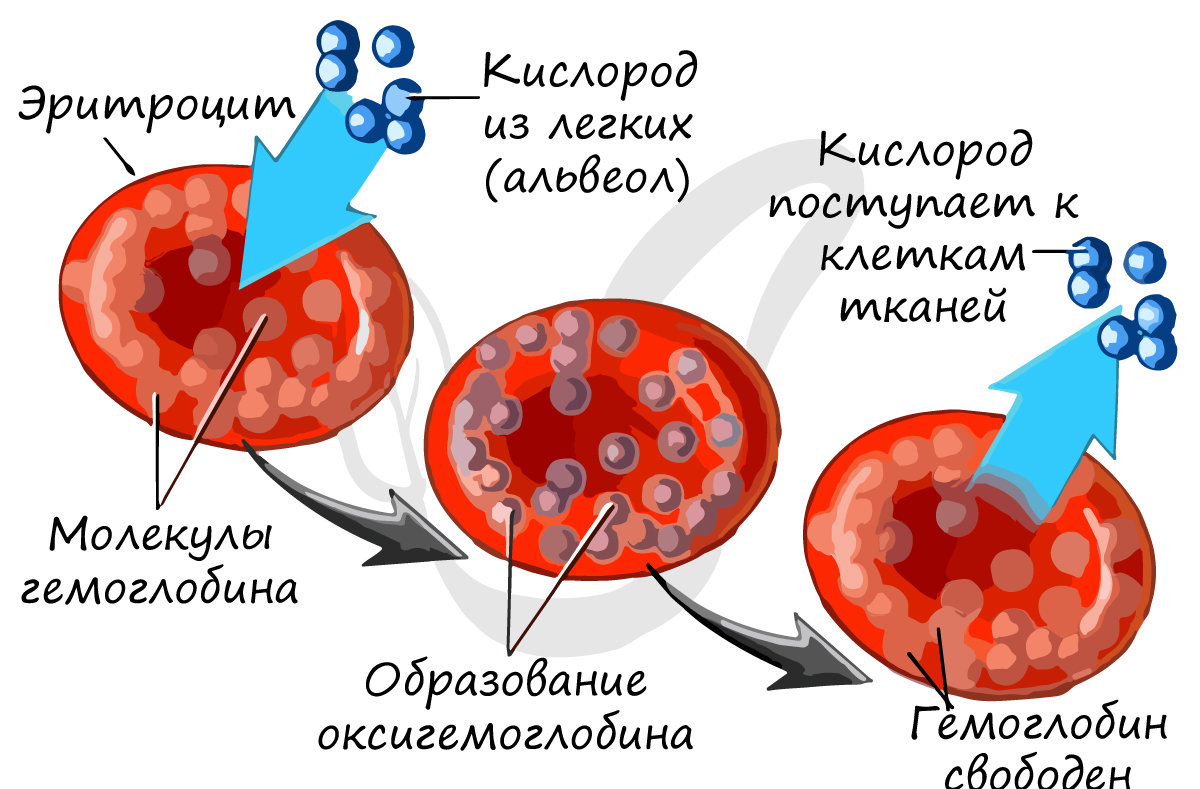
Эритроциты имеют характерную двояковогнутую форму, лишены ядра (в отличие от эритроцитов других животных, например,
эритроциты лягушки содержат ядро). Их маленький диаметр и способность складываться помогает им проникать через самые
мельчайшие сосуды нашего тела — капилляры, диаметр которых меньше, чем диаметр эритроцита!
Эритроциты дифференцируются в красном костном мозге (в губчатом веществе костей), срок их жизни составляет 120 дней. К окончанию жизненного цикла их форма становится шарообразной. Такие старые шарообразные эритроциты
задерживаются в печени и селезенке, которая называется кладбищем эритроцитов. Здесь они разрушаются, а их остатки
фагоцитируются.
Из статьи о легких вы уже знаете, что гемоглобин образует соединения:
Сродство гемоглобина к угарному газу в 300 раз выше, чем к кислороду, поэтому карбоксигемоглобин
очень устойчив.
Вообразите: при содержании во вдыхаемом воздухе 0,1% угарного газа 80% от общего количества гемоглобина
связываются с угарным газом, а не с кислородом! Угарный газ образуется при пожарах в замкнутом пространстве,
отравиться им и потерять сознание можно очень быстро. Если немедленно не вынести человека на свежий воздух,
то летальный исход становится неизбежным.

Запомните, что у людей, живущих в горной местности, количество эритроцитов в крови несколько выше, чем у
обитателей равнины. Это связано с тем, что концентрация кислорода в горах ниже средней, вследствие чего
компенсаторно увеличивается содержание эритроцитов в крови, чтобы переносить больше кислорода.

Лейкоциты — белые кровяные тельца, имеющие ядро и не содержащие гемоглобин. Дифференцируются в красном костном мозге,
лимфатических узлах. С кровью переносятся к тканям организма, где проходит основная часть их жизненного цикла: они выполняют защитную функцию, которая заключается в:
Число лейкоцитов в 1 мм3 крови 4-9 тысяч. Лейкоциты разнообразны по форме и строению, среди них встречаются
нейтрофилы, лимфоциты, моноциты. Их деятельность направлена на защиту организма: они обеспечивают иммунитет.
Если количество лейкоцитов
увеличено в анализе крови, то врач может заподозрить инфекционный процесс: при его наличии количество лейкоцитов возрастает, чтобы
уничтожить бактерии и вирусы, попавшие в организм.
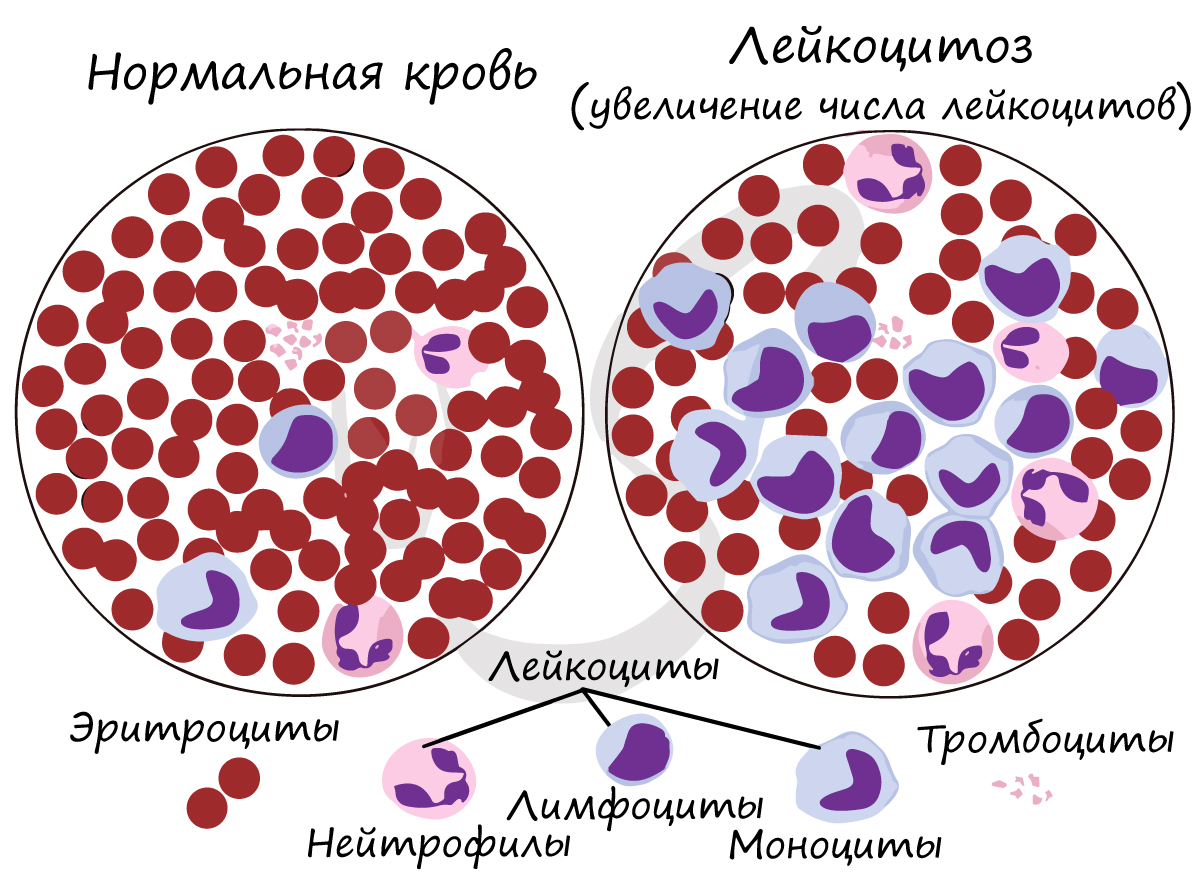
Около 25-40% от всех лейкоцитов составляют лимфоциты, в популяции которых можно обнаружить T- и B-лимфоциты. Они
выполняют важнейшие функции, благодаря которым формируется иммунитет.
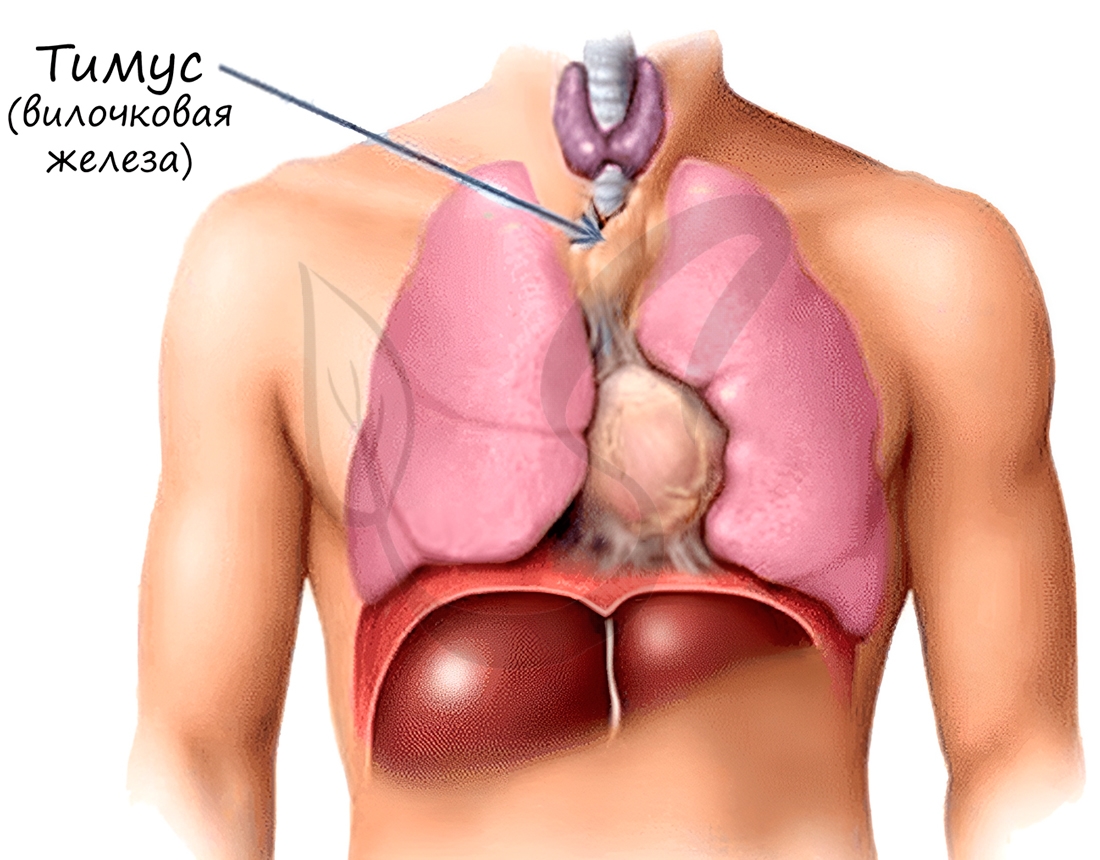
T-лимфоциты созревают в специальном органе — тимусе (вилочковой железе). Они обеспечивают клеточный иммунитет, выявляют
и уничтожают мутантные (раковые) клетки, миллионы которых ежедневно образуются даже у здорового человека. Уничтожают в организме подобные клетки T-лимфоциты путем фагоцитоза.
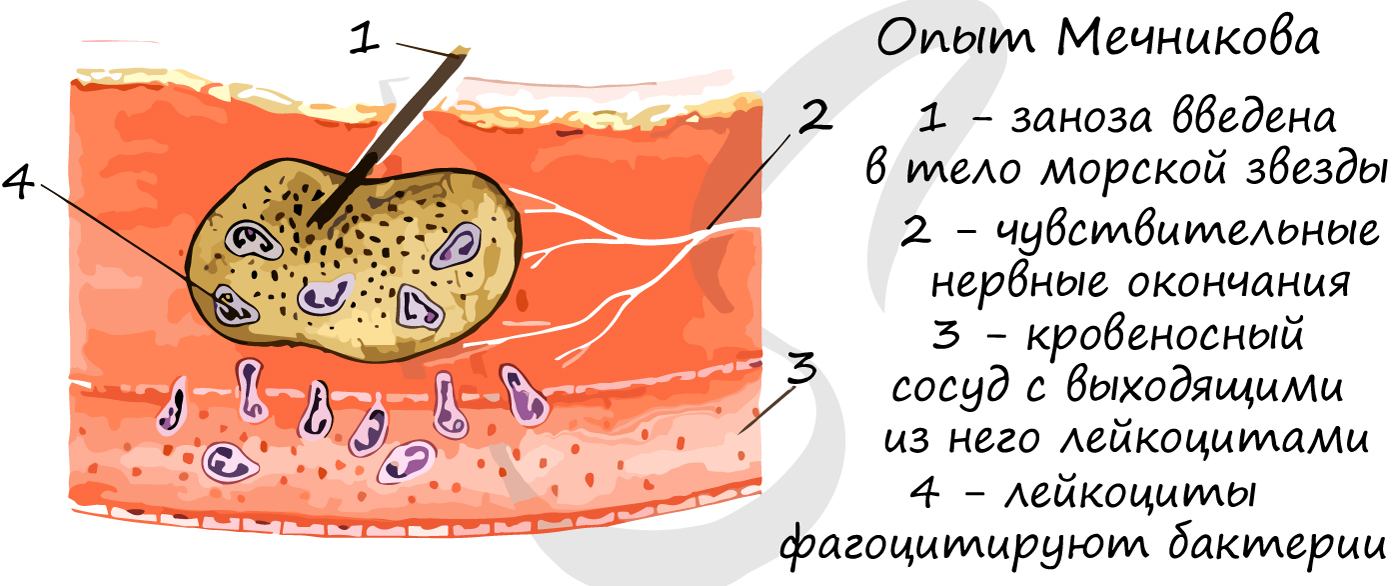
Фагоцитоз — процесс, при котором клетки захватывают и переваривают твердые частицы (другие клетки). Создатель фагоцитарной
теории иммунитета И.И. Мечников провел опыт, который наглядно демонстрирует, что лейкоциты способны выходить из кровеносного
русла в ткани (при воспалении), фагоцитировать попавшие в рану чужеродные белки, бактерии.
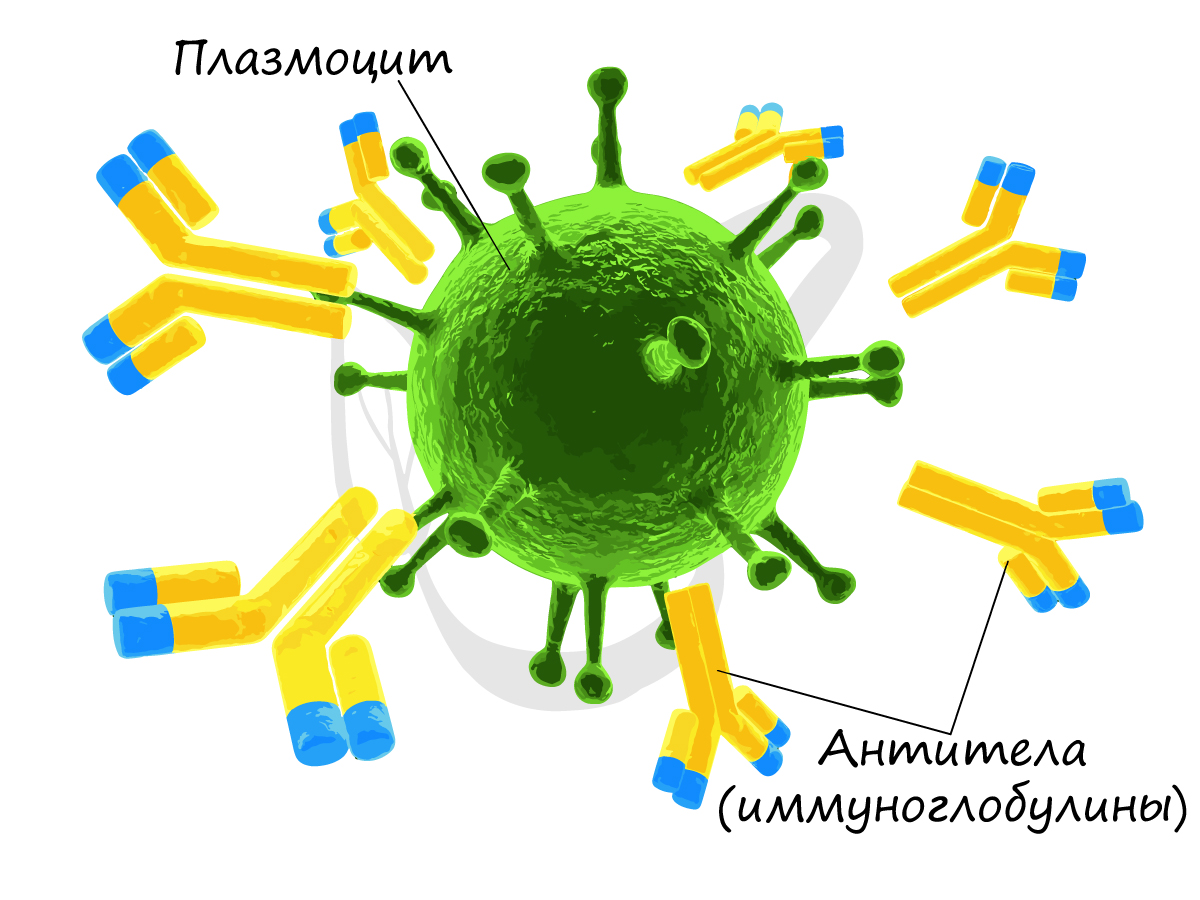
Гуморальный (греч. humor — жидкость) иммунитет обеспечивается B-лимфоцитами. После контакта с антигеном (чужеродное вещество в организме) B-лимфоцит
превращается в плазмоцит — клетку, которая вырабатывает антитела. Антитела (иммуноглобулины) — белковые молекулы, препятствующие размножению микроорганизмов и нейтрализующие выделяемые ими токсины.
Часть плазмоцитов может оставаться в организме после устранения антигена многие годы, эта часть обеспечивает иммунную память, благодаря которой
в случае повторного попадания того же антигена — человек не заболеет, либо легко и быстро перенесет болезнь.
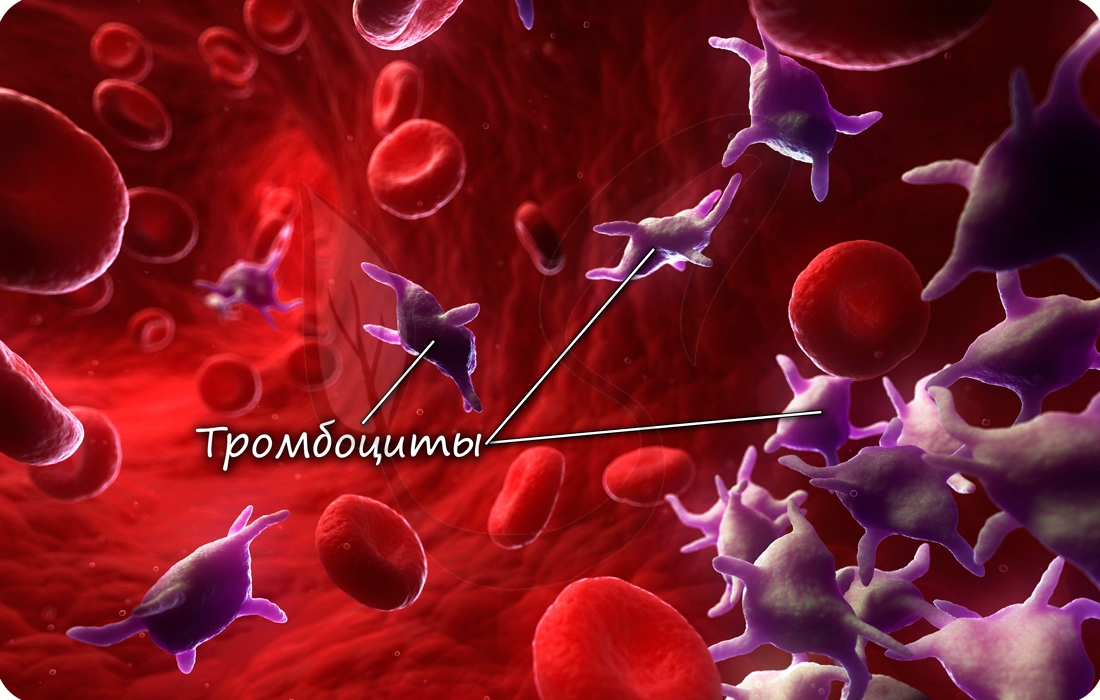
Устаревшее название тромбоцитов — кровяные пластинки. Тромбоциты — клеточные элементы крови, представляющие собой круглые безъядерные
образования. В 1 мм3 насчитывается 250-400 тысяч клеток.
Дифференцируются (образуются) тромбоциты в красном костном мозге. На их поверхности имеются рецепторы,
которые активируются при повреждении кровеносного русла. Они играют важную роль в процессе
гемостаза — свертывания крови, предотвращают кровопотерю.
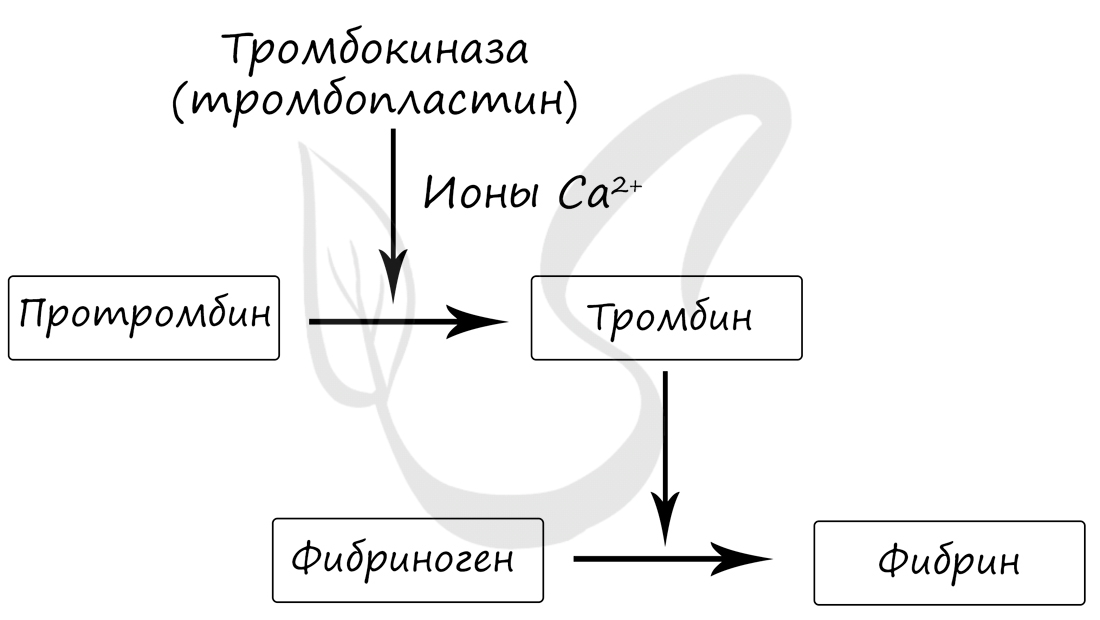
Процесс гемостаза требует нашего особого внимания. Гемостаз (от греч. haima — кровь + stasis — стояние) —
процесс свертывания крови, являющийся важнейшим защитным механизмом от кровопотери. Активируется при
повреждении кровеносных сосудов.
Гемостаз зависит от множества факторов, среди которых важное место отводится ионам Ca2+. Гемостаз происходит
следующим образом: при повреждении сосуда из тромбоцитов высвобождаются тромбопластины, которые способствуют переходу протромбина в тромбин. В свою очередь, тромбин способствует переходу растворимого белка крови, фибриногена, в нерастворимый фибрин.
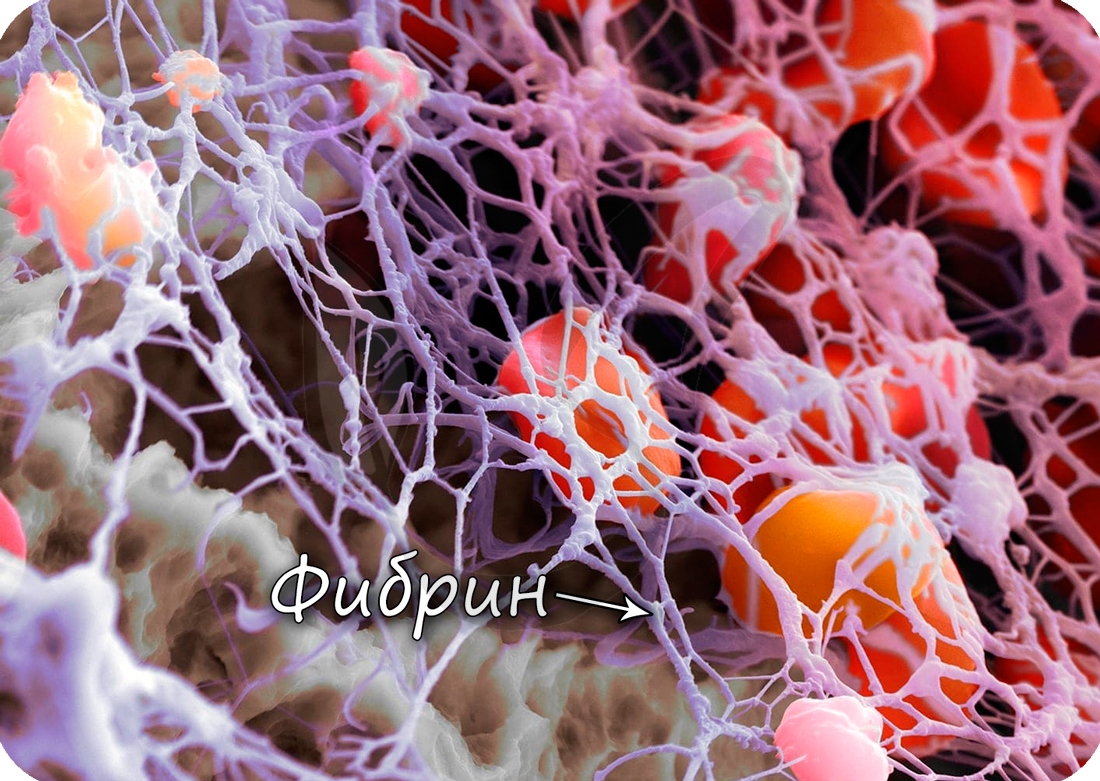
Истинный тромб образуется при переходе растворимого белка крови, фибриногена, в нерастворимый фибрин, нити которого
создают «сетку», где застревают эритроциты. В результате останавливается кровотечение из сосуда.
Группы крови и трансфузия (переливание)
Не могу утаить, что существует более 30 различных систем групп крови. Наиболее широко используемая (в том числе и в
медицине при переливании крови) — система AB0. Она основана на том факте, что на мембране эритроцитов располагаются различные
антигены, определенные генетически. На основании сходства этих антигенов людей делят на 4 группы.
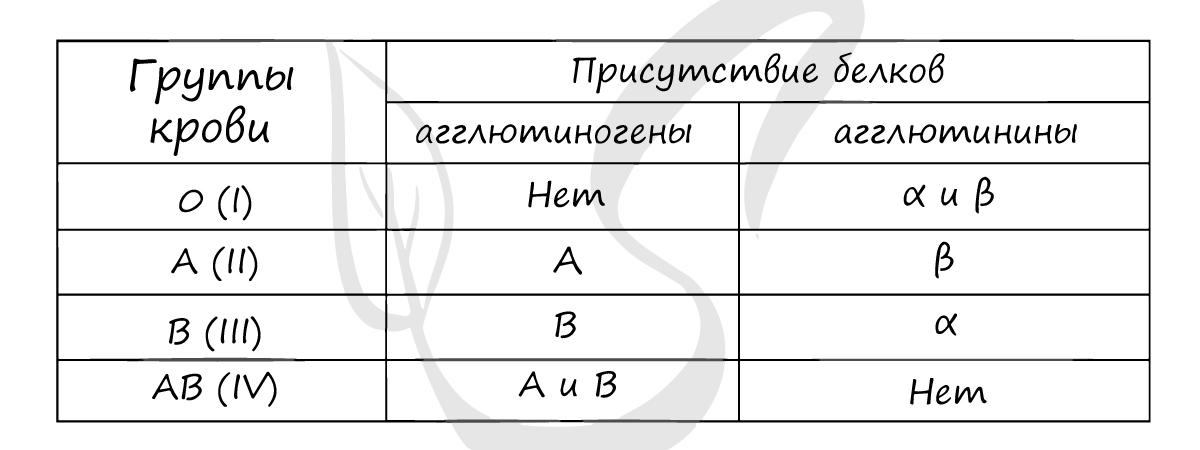
Наибольшее значение в системе AB0 имеют агглютиногены A и B, расположенные на поверхности эритроцитов, и агглютинины α и β.
Если встречаются два одинаковых компонента, к примеру: агглютиноген A и агглютинины α, то начинается реакция агглютинации —
эритроциты начинают склеиваться.
Агглютинацию ни в коем случае нельзя допустить, она может сильно ухудшить состояние пациента
вплоть до летального исхода. При переливании крови строго соблюдается следующее правило: переливается только кровь,
относящаяся к одной и той же группе. Это наилучший вариант, однако, и здесь бывают неудачные переливания, заканчивающиеся
гибелью пациента, ведь ранее я уточнил, что система AB0 является лишь одной из 30 систем групп крови, а учесть их все
не представляется возможным.
Ниже вы найдете схему, где группы крови (по системе AB0) проверяют на совместимость. Реципиентом называют того, кому переливают кровь,
а донором — от кого переливают. Если вы видите сгустки эритроцитов, то это значит, что произошла агглютинация, и переливание крови от донора к реципиенту ни к чему хорошему не приведет.
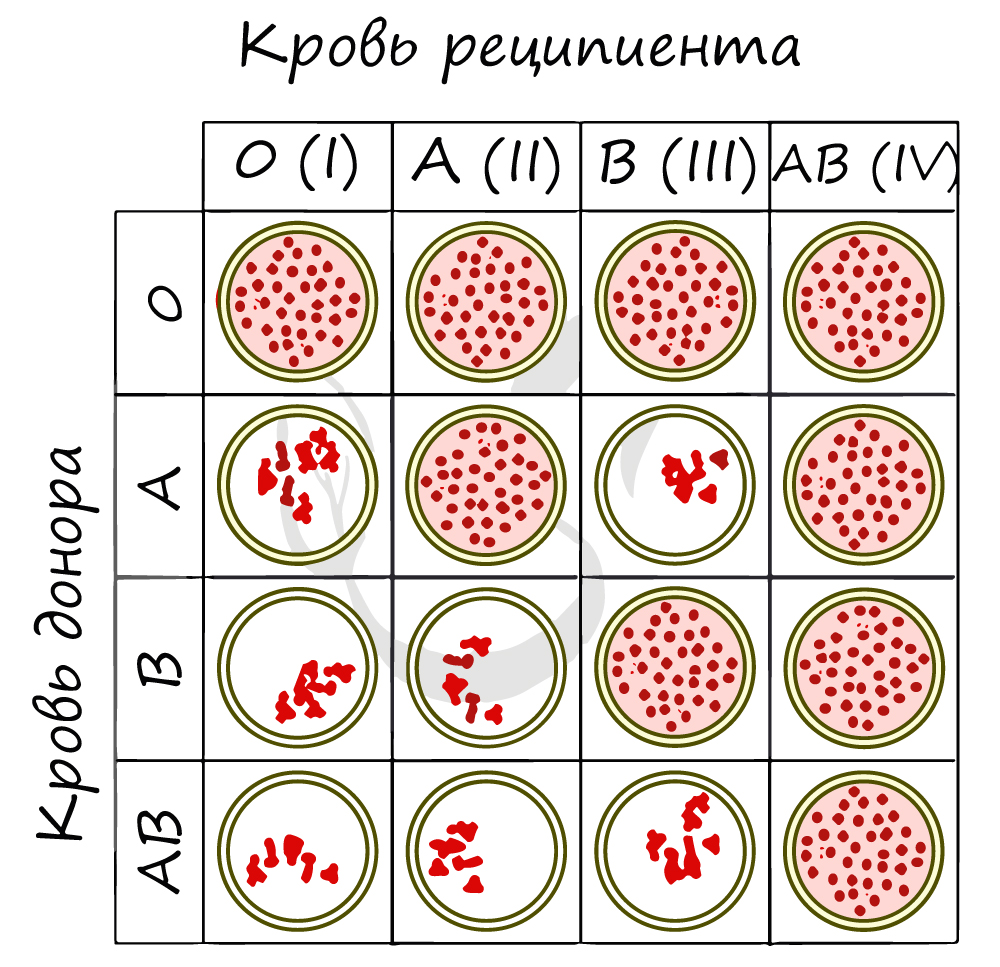
В рамках заданий ЕГЭ (по опыту решений) переливанию подвергаются именно эритроциты, то есть агглютиногены. Для более полного понимания рассмотрим два случая.
1) При переливании крови от донора 0 к реципиенту A (II) агглютинации не происходит (кровь донора не содержит агглютиногенов).
2) При переливании крови от донора A к реципиенту 0 (I) агглютинация происходит (кровь донора содержит агглютиноген A).
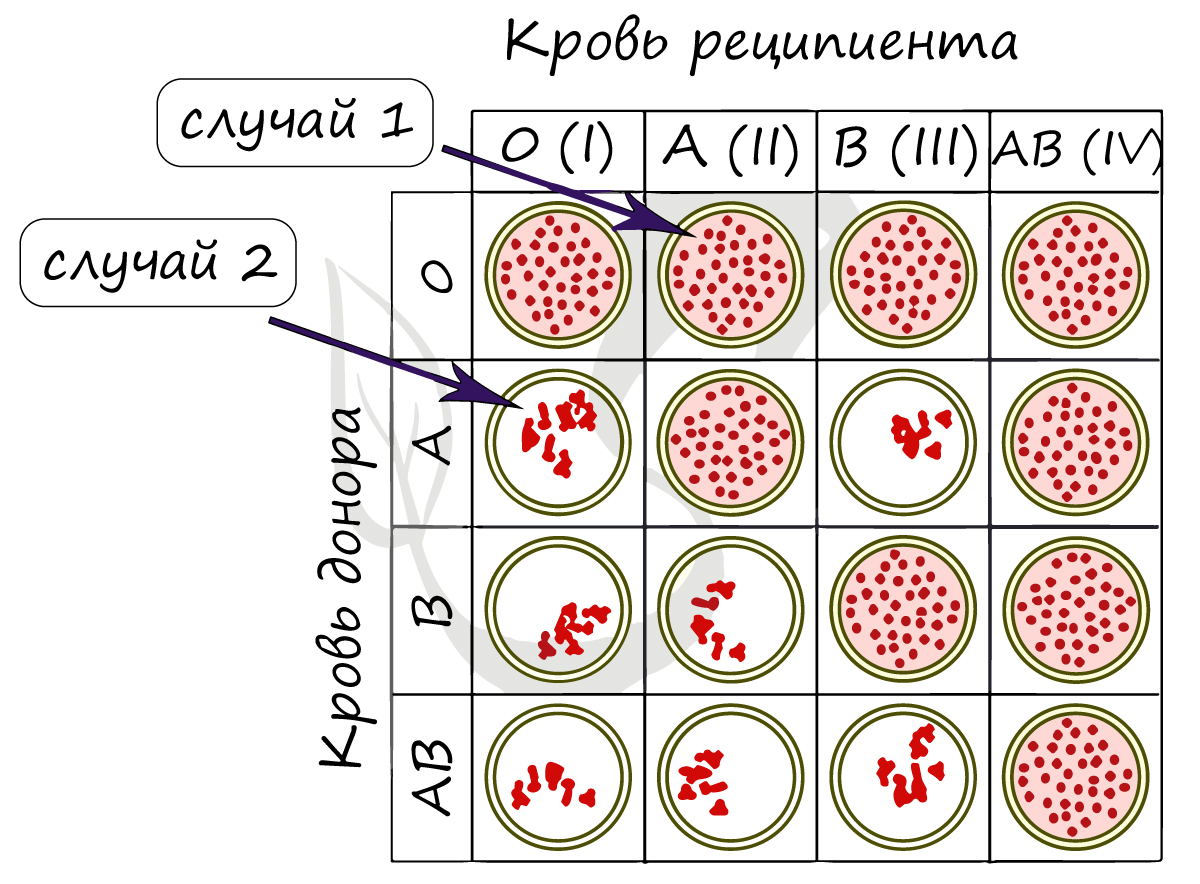
Из-за того, что вместе оказываются агглютинин α и агглютиноген A между эритроцитами начинается агглютинация — они
склеиваются.
Резус-фактор (Rh-фактор) и резус-конфликт
Помимо агглютиногенов системы AB0 на поверхности эритроцитов могут присутствовать резус-антигены. «Могут» — потому что
у большинства людей они есть (85%), а у некоторых резус-антигены отсутствуют (15%). Если данные белки имеются, то
говорят, что у человека положительный резус-фактор, если белки отсутствуют — отрицательный резус-фактор.
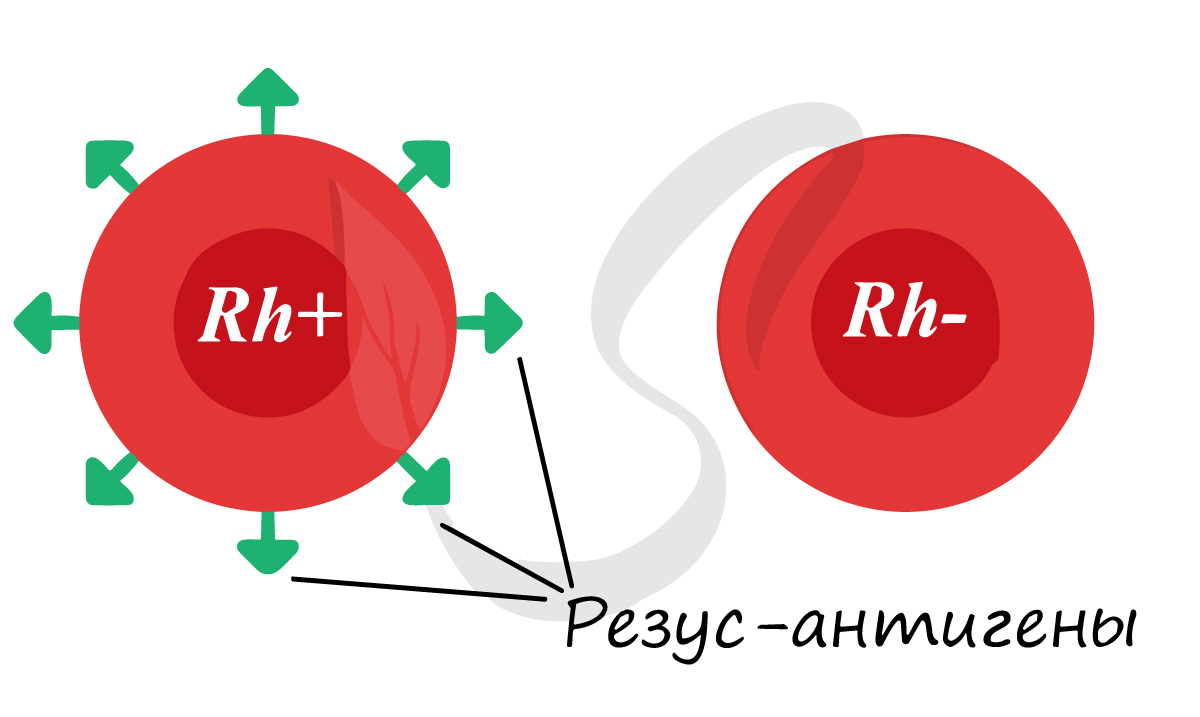
Особую важность приобретает резус-фактор у матери и плода. Если женщина резус-отрицательна, а плод
резус-положителен, то при повторной беременности существует риск резус-конфликта: антитела матери начнут атаковать
эритроциты плода, которые разрушатся и плод погибент от гипоксии (нехватки кислорода).
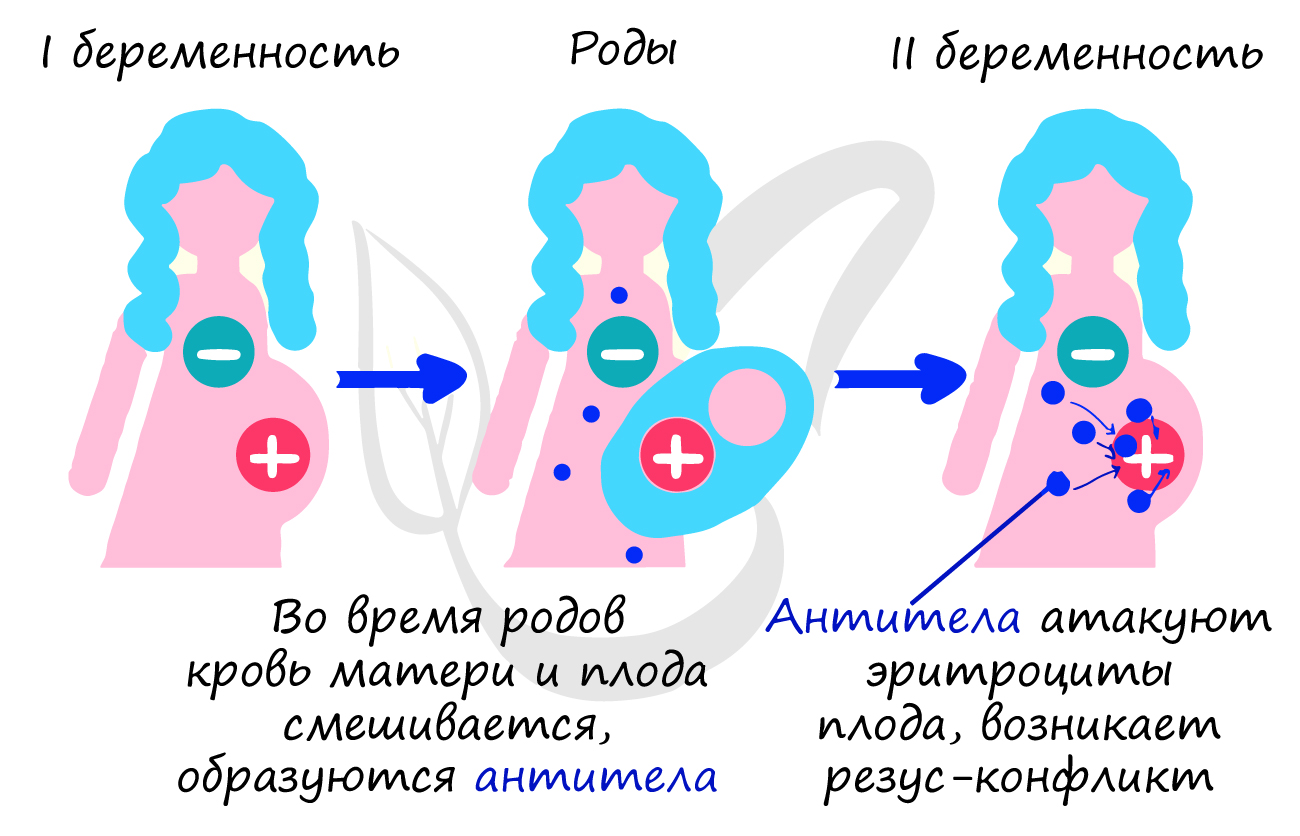
Заметьте — при первой беременности нет угрозы резус-конфликта. Если женщина резус-положительна, то никакого резус-конфликта
не может быть априори, независимо от того резус-положительный или резус-отрицательный плод.
Опасность резус-конфликта вовсе не значит, что вы должны выбирать свою половинку руководствуясь наличием или отсутствием
резус-антигенов)) Они не должны вам препятствовать!) Доложу вам, что на сегодняшней день арсенал лекарственных препаратов
помогает устранить резус-конфликт и успешно рожать женщине во 2, 3, и т.д. раз. Главное, чтобы беременность протекала под наблюдением врача с самого раннего срока.
Лимфа, лимфатическая система
Лимфа, как и кровь, образует внутреннюю среду организма. В самом начале статьи была схема, на которой видно, как кровь,
тканевая жидкость и лимфа соотносятся друг с другом. В норме избыток жидкости выводится из тканей по лимфатическим сосудам.
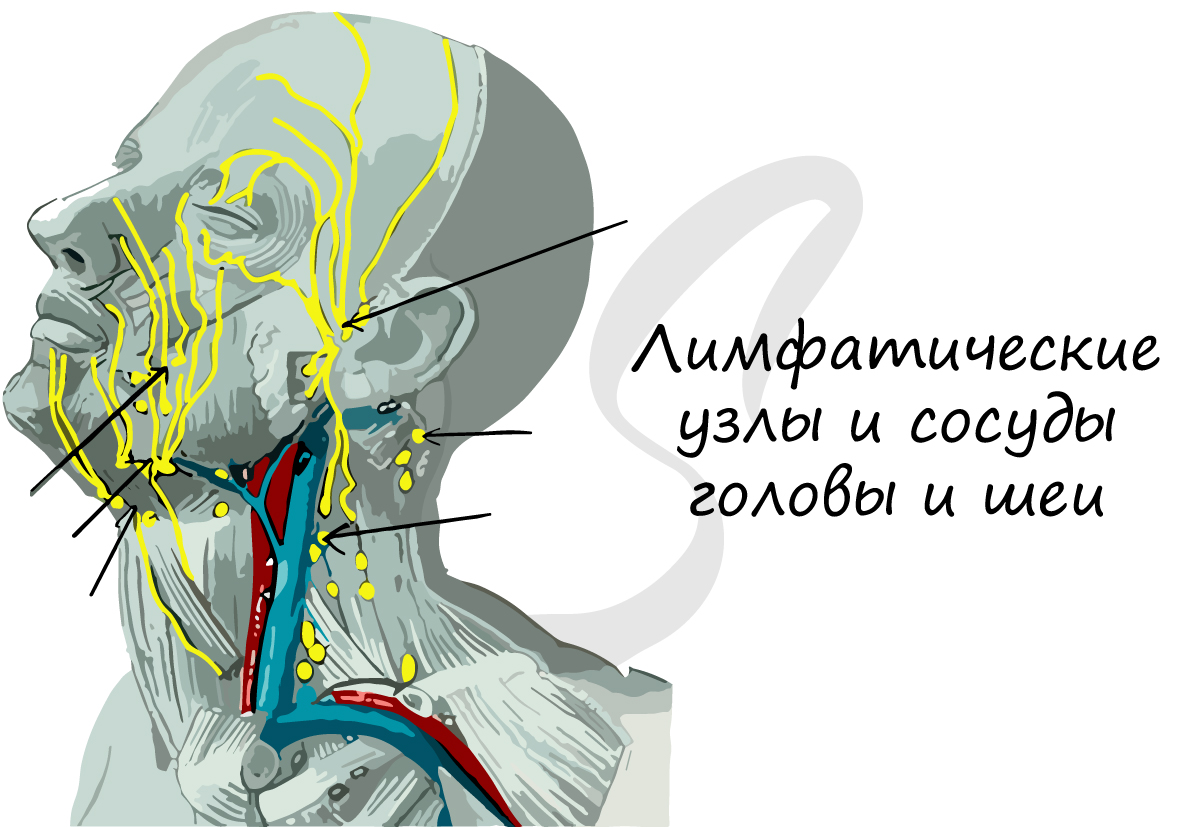
Состав лимфы близок к плазме крови: в лимфе можно обнаружить антитела, фибриноген и ферменты. Лимфатические сосуды
впадают в лимфатические узлы, которые М.Р. Сапин, выдающийся анатом, называл «сторожевые посты». Здесь появляются
лимфоциты — важнейшее звено иммунитета, и происходит фагоцитоз бактерий.
Подытоживая полученные знания, давайте соберем вместе функции лимфатической системы:
- Защитная — в лимфатических узлах образуются лимфоциты, происходит фагоцитоз бактерий
- Транспортная — в лимфатические сосуды кишечника всасываются жиры
- Возврат белка в кровь из тканевой жидкости
- Перераспределение жидкости в организме
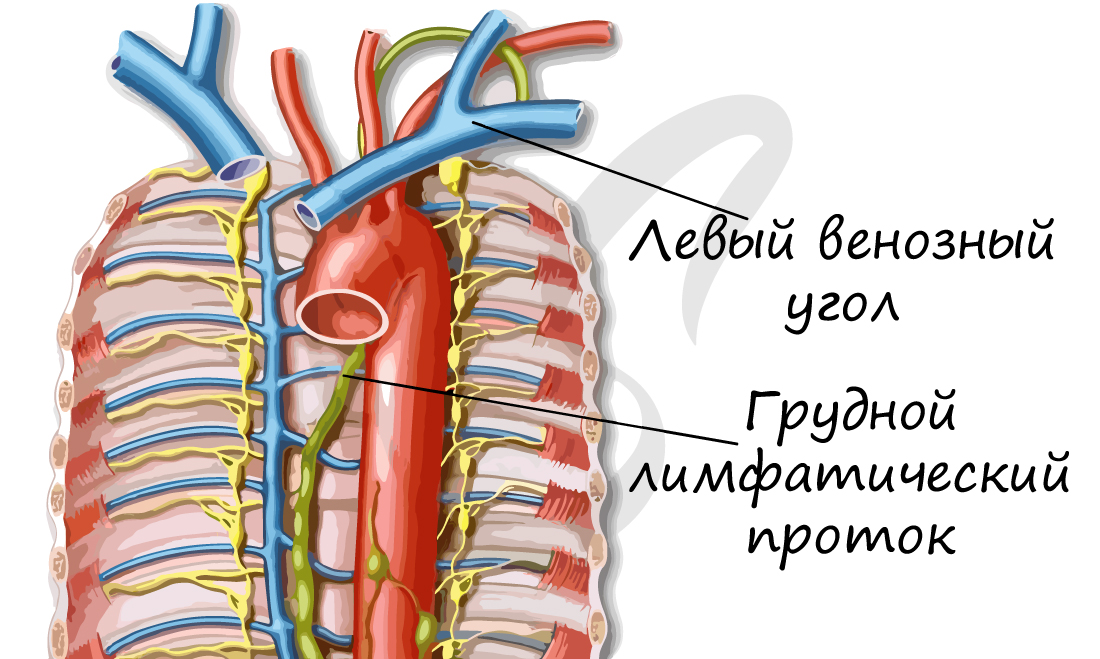
Куда же течет вся лимфа с жирами, лимфоцитами и белками? В конечном итоге лимфатическая система соединяется с кровеносной,
впадая в нее в области левого и правого венозных углов. Таким образом, лимфатическая и кровеносная системы теснейшим образом
связаны друг с другом.
Виды иммунитета
Мы уже отчасти касались темы иммунитета в нашей статье и отмечали особый вклад И.И. Мечникова в создании фагоцитарной теории
иммунитета.
Иммунитет — способ защиты организма и поддержания гомеостаза внутренней среды, предупреждающий размножение
в организме инфекционных агентов. Выделяют естественный и искусственный иммунитет.
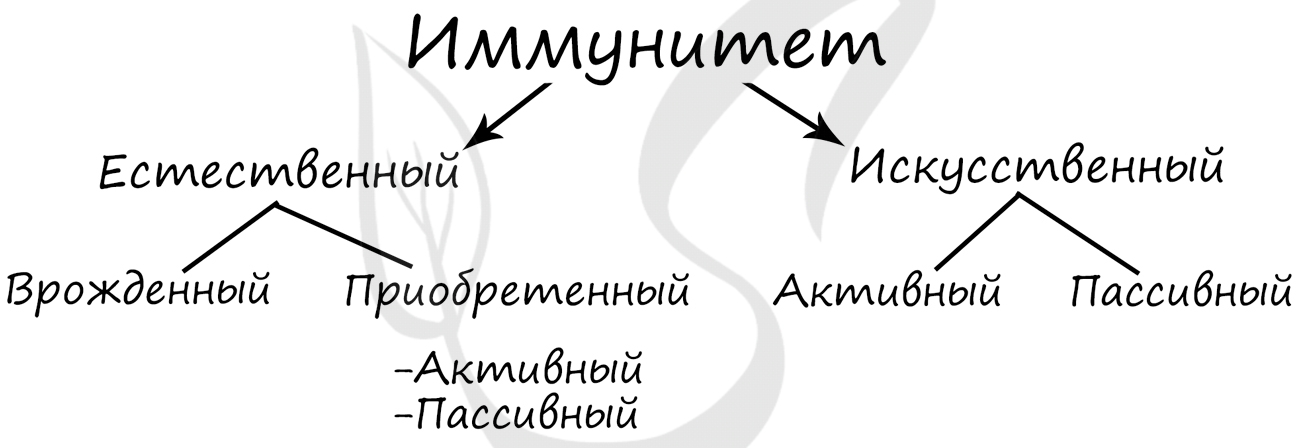
Естественный иммунитет включает в себя врожденный (видовой) и приобретенный (индивидуальный).
Врожденный иммунитет заключается в невосприимчивости человека к болезням животных: человек не может заболеть многими
болезнями собак, и, наоборот, собаки невосприимчивы ко многим заболеваниям человека.
Приобретенный (индивидуальный) иммунитет бывает активный и пассивный.
- Активный
- Пассивный
Вырабатывается человеком в ответ на внедрение инфекционного агента через 10-12 дней (образование антител)
Состоит в переходе материнских антител в кровь плода, также антитела поступают вместе
с грудным молоком. Пассивным этот вид иммунитета называется потому, что сам организм антитела не вырабатывает, а использует уже готовые.
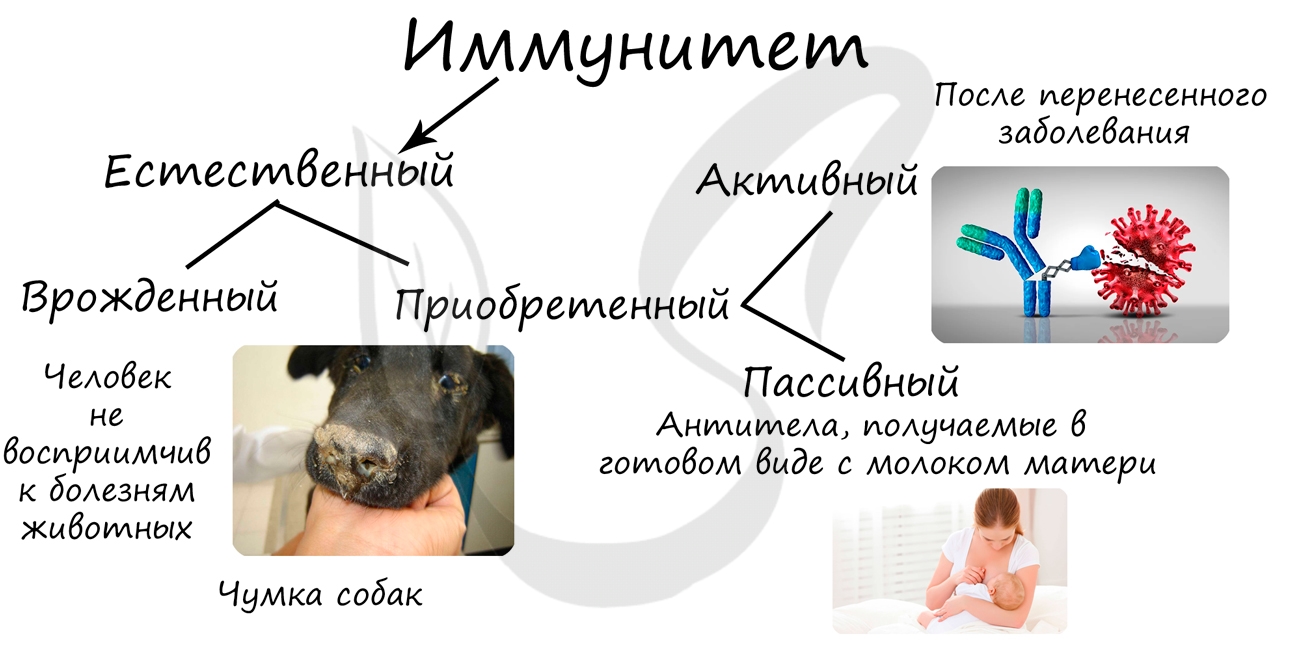
Искусственный иммунитет делится на активный и пассивный.
Активный искусственный создается с помощью прививок — вакцинации. При вакцинации в организм здорового человека вводят разрушенные или ослабленные инфекционные агенты (вакцину), с которыми лейкоциты легко справляются, в результате чего вырабатываются антитела. Это напоминает тренировку перед матчем: когда настоящий вирус/бактерия попадут
в организм, лейкоцитам будет все о них известно, и они быстро выработают антитела, за счет чего заболевание пройдет либо в легкой,
либо в бессимптомной форме.
Пассивный искусственный иммунитет подразумевает применение лечебной сыворотки, которая содержит готовые антитела к возбудителю
заболевания. Часто сыворотки применяются в экстренных случаях, когда заболевание протекает тяжело и медлить нельзя. Существует
противоботулиническая сыворотка (применятся при тяжелейшем заболевании — ботулизме), антирабическая сыворотка (против вируса
бешенства).
Лечебные сыворотки получают из крови животных, зараженных определенным вирусом или бактерией. Получение сыворотки заключается
в выделении из крови готовых антител к данному возбудителю. Применяются сыворотки не только в лечебных, но и в профилактических
целях.
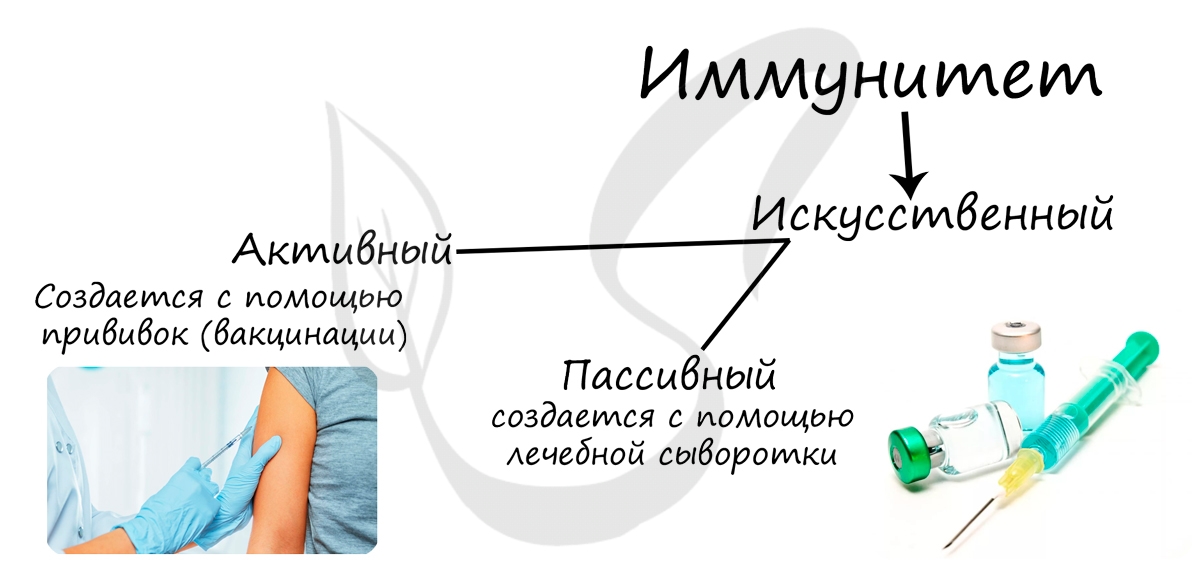
Позвольте добавить краткую и важную историческую сводку. Первая прививка была сделана Эдвардом Дженнером в 1796 году. Он заметил, что
доярки, переболевшие коровьей оспой, невосприимчивы к натуральной. Получив согласие родителей ребенка, Дженнер заразил ребенка (!) коровьей оспой, тот перенес ее и через две недели был невосприимчив к натуральной оспе. Так Эдвард Дженнер начал эпоху вакцинации.

Луи Пастер также внес огромнейший вклад, создав и сделав первую прививку от бешенства в 1885 году. Мать привезла к нему в Париж сына,
которого покусала бешеная собака. Было очевидно, что без вмешательства мальчик умрет. Пастер взял на себя огромную ответственность (к слову,
не имея врачебной лицензии) и 14 дней вводил мальчику изобретенную вакцину. Мальчик вылечился, симптомы бешенства не развились. Примечательно,
что всю взрослую жизнь спасенный юноша посвятил Пастеру, работая сторожем в Пастеровском музее.

Заболевания
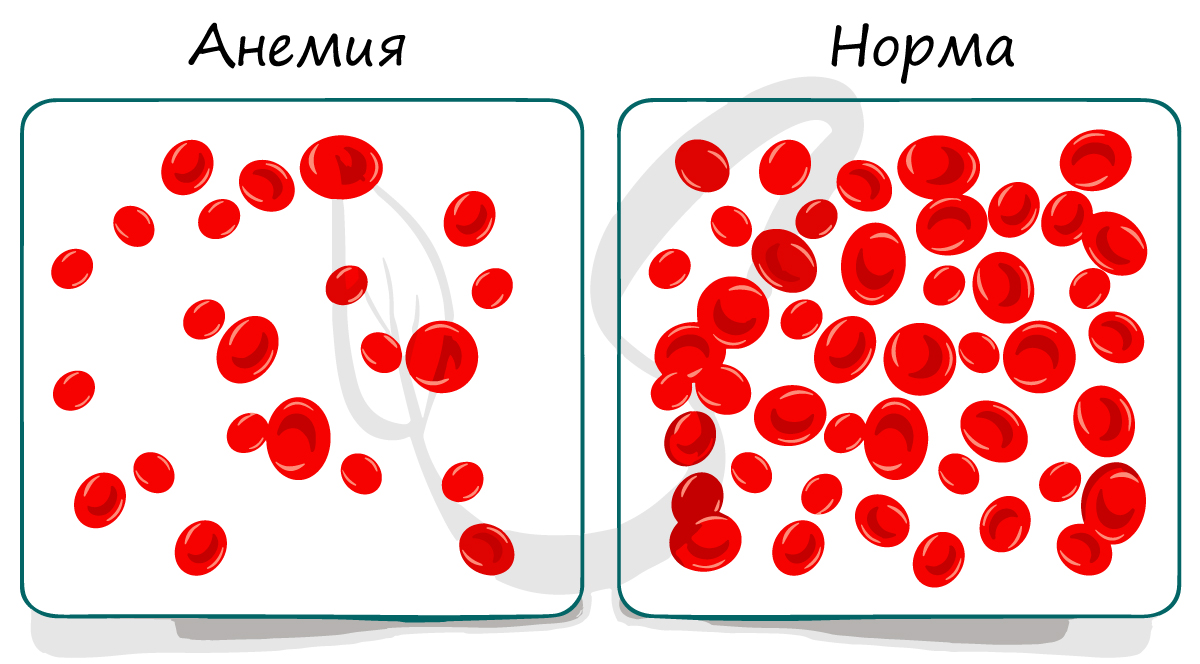
Анемия (от др.-греч. ἀν- — приставка со значением отрицания и αἷμα «кровь»), или малокровие — снижение концентрации гемоглобина в крови,
очень часто с одновременным уменьшением количества эритроцитов. Вам уже известна основная функция эритроцитов, и вы легко сможете догадаться,
что при анемии кислорода к тканям поступает меньше должного уровня — отсюда и развиваются симптомы анемии.
Пациенты могут жаловаться на непривычную одышку (учащение дыхания) при незначительных физических нагрузках, общую слабость, быструю утомляемость,
головную боль, сердцебиение, шум в ушах. При анализе крови анемию выявить легко, гораздо сложнее выявить причину, из-за которой анемия возникла.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
High Altitude
V. Courtney Broaddus MD, in Murray & Nadel’s Textbook of Respiratory Medicine, 2022
Oxygen-Hemoglobin Affinity
A critical feature of oxygen transport at high altitude is that the hemoglobin-oxygen dissociation curve is much steeper as arterial Po2 falls to less than 60 mm Hg. On ascent, with the Po2 on the steep portion of the curve, arterial oxygen saturation (arterial So2) falls precipitously with only a small decrease in Po2. Potential impacts on oxygen delivery are mitigated by adaptations in the dissociation curve. Because of the increase in ventilation and resulting respiratory alkalosis, the curve shifts leftward, enhancing oxygen loading and increasing arterial oxygen content, but at the expense of decreased tissue oxygen off-loading. Over several days, the dissociation curve shifts back rightward as RBC 2,3-diphosphoglycerate increases,44 and the pH decreases because of renal compensatory responses.
Liposome-Encapsulated Hemoglobin: History, Preparation and Evaluation
Vibhu D. Awasthi PhD, … William T. Phillips MD, in Blood Substitutes, 2006
Oxygen affinity
Oxygen affinity is measured as the partial pressure of oxygen to saturate 50 per cent of hemoglobin (P50). Normal P50 of human hemoglobin in RBCs is about 27 mmHg (Bunn and Forget, 1986). Certain substances called allosteric modifiers, such as 2,3-diphosphoglycerate (2,3-DPG), affect the oxygen affinity of hemoglobin (Miller et al., 1970). Other substances with hemoglobin-modifying properties similar to 2,3-DPG are pyridoxal 5’-phosphate (PLP) and inositol phosphate (IP) (Goodford et al., 1978). A synthetic compound, RSR13, is also capable of changing hemoglobin oxygen affinity (Miyake et al., 2003). Hemoglobin oxygen affinity in LEH is easily altered by co-encapsulation of PLP (Sakai et al., 2000; Sou et al., 2003) or IP (Usuba and Motoki, 1995). Although it has long been believed that artificially assembled HBOCs should have a P50 close to that of RBCs, recent findings have supported the use of low P50 HBOCs in severe blood loss. It has been demonstrated that under mild hypoxia a high P50 may be helpful, while in severe hypoxia a low P50 may be beneficial (Kavdia et al., 2002). Animal experiments also support this view (Eichelbronner et al., 2002; Baines and Ho, 2003; Shirasawa et al., 2003; Winslow and Kramer, 2003). Interestingly, LEH with a low affinity has also been found to have improved oxygen delivery and functional capillary density (Sakai et al., 1999).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780127597607500548
Sickle Cell Disease
Rick D. Kellerman MD, in Conn’s Current Therapy 2021, 2021
Modulation of Hemoglobin Oxygen Affinity
Deoxygenation of HbS leads to polymerization, sickling, and hemolysis. Thus strategies aimed at increasing the oxygen affinity of HbS may be beneficial. Clinical trials in adults and children have shown reduced hemolysis and improved hemoglobin with voxelotor, a once daily oral drug that increases the oxygen affinity of hemoglobin maintaining it in the oxygenated state and reducing polymerization and sickling. Unfortunately, these changes were not accompanied by a statistically significant reduction in vaso-occlusive episodes. Voxelotor (Oxbryta) was also approved by the FDA for the treatment of SCD in November 2019.
Oxygen Transport and Delivery
Patrick J. McNamara, Afif El-Khuffash, in Fetal and Neonatal Physiology (Fifth Edition), 2017
Interactions: Affinity/Release
Hemoglobin oxygen affinity is the continuous relationship between hemoglobin oxygen saturation and oxygen tension. It is customarily plotted as the sigmoidal oxygen equilibrium curve, and it can be summarily expressed as P50—that is, the oxygen tension at which 50% of hemoglobin is saturated with oxygen at standard temperature and pH (Figure 71-2). The sigmoidal shape of the oxygen-hemoglobin equilibrium curve relates to the fact that the heme groups react with oxygen in a fixed sequence, and oxygenation and deoxygenation of one heme group profoundly affect the oxygenation and deoxygenation of the other heme groups. This latter phenomenon has been termed heme-heme interaction. As each heme group accepts oxygen, it becomes progressively easier for the next heme group of the molecule to pick up oxygen. This concept is implicit in the Hill equation for percent saturation:
where y is percent saturation with oxygen, k is an equilibrium constant, Po2 is oxygen partial pressure, and the exponent n is the average number of iron atoms per hemoglobin molecule. For normal hemoglobin, n is approximately 2.9.
As blood circulates through the normal lung, Po2 increases from approximately 40 mm Hg to 110 mm Hg, a pressure sufficient to ensure at least 95% saturation of hemoglobin with oxygen. The oxygen-hemoglobin equilibrium relationship is such that any further increase of oxygen tension in the lung results in only a small increase in saturation. In the normal adult, when oxygen tension has fallen to approximately 27 mm Hg, at a pH of 7.40 and a temperature of 37° C, 50% of hemoglobin is saturated with oxygen (i.e., P50 for whole blood is 27 mm Hg).
The steep and flat parts of the curve reflect definitive processes in oxygen unloading. As oxygen diffuses from capillary to tissue, at first a rapid fall in Po2 (represented by the flat part of the curve) occurs until the steep part is reached, after which capillary Po2 decreases little even though large amounts of oxygen are released. Because oxygen tension at the mitochondrial surface, the point of oxygen utilization, is always approximately 0.5 to 1.0 mm Hg,5 the driving pressure for, and consequently the rate of, oxygen delivery is determined solely by the mean Po2 in capillary blood. This is in turn set by the position of the dissociation curve on the Po2 axis and by its steepness, such that relatively little change in driving pressure occurs as the red blood cell moves through the capillary. As the partial pressure of oxygen decreases, tissue oxygenation may become impaired. The term critical Po2 was introduced to indicate the oxygen tension of blood below which diffusion is impaired and organ function is disturbed.24 A critical Po2 cannot be a well-defined value, as cellular needs will likely vary between organs and are influenced by metabolic activity. For example, in the brain, an organ in which an adequate oxygen supply is essential for maintaining energy metabolism, the critical Po2 appears to be approximately 20 mm Hg.
When hemoglobin oxygen affinity is increased (i.e., with lower P50), the curve is shifted to the left, and oxygen (which is bound more tightly to hemoglobin) is released only at lower partial pressures. For example, whereas a Po2 of 40 mm Hg results in an oxygen saturation of 75% at 37° C and pH 7.40, a leftward shift of the curve results in a higher saturation at the same Po2. The resulting change in oxygen unloading ultimately could result in impaired diffusion. When affinity is decreased (i.e., with higher P50), the curve is shifted to the right. Consequently, oxygen is bound less tightly to hemoglobin and is released at higher partial pressures, thereby enhancing oxygen unloading at the tissue level. Therefore the release of oxygen from the blood at the tissue level depends on the position of the oxygen equilibrium curve, which in turn is modified by intraerythrocytic pH, Pco2, temperature, and other factors, including electrolyte concentration, organic phosphate levels, and hemoglobin type.
The effect of temperature on the oxygen equilibrium curve was first noted by Barcroft and King25 in 1909. Increased temperature shifts the curve towards the right, thereby facilitating the release of oxygen. In addition, changes in temperature alter both the Bohr factor and the 2,3-diphosphoglycerate (2,3-DPG) effect26 (discussed in the following section). The Bohr effect is the shift to the right of the oxygen equilibrium curve of both adult and fetal blood in response to an increase in PCO2 or a decrease in pH, or both. Oxygen unloading is determined by the Po2 gradient between blood and tissues. The shift of the oxyhemoglobin dissociation curve to the right as carbon dioxide enters the blood from the tissues tends to raise the oxygen tension, increasing the gradient for any given oxyhemoglobin saturation and facilitating transfer of oxygen to the tissues. The change in log P50 per unit change in pH (i.e., –Δlog P50/–ΔpH) is known as the Bohr factor. Its value for adult human blood is –0.48, and for the newborn infant it is –0.44. The effective pH is the intracellular pH of the red blood cell, which is usually 0.2 unit less than plasma pH at physiologic levels, although the pH gradient across the red blood cell may vary in disease states. Thus an acute change in pH of 0.1 unit changes P50 by approximately 3 mm Hg. The Bohr effect is more pronounced, at least experimentally, as oxygen saturation decreases and is diminished in 2,3-DPG-depleted blood.27
The Bohr effect produced by varying Pco2 at constant fixed acid is larger (–0.48) than that induced by alterations in metabolic acids at constant Pco2 (–0.40).27 The molecular basis of the carbon dioxide effect is two-fold: It follows both carbon dioxide–induced changes in pH and the action of carbon dioxide as a ligand, binding reversibly to uncharged amino groups in the hemoglobin molecule to form carbamates.28,29 Bound carbamates form salt bridges, stabilizing the T (deoxy) conformation of hemoglobin and decreasing hemoglobin oxygen affinity. In addition, the affinity of other sites on the hemoglobin molecule for the hydrogen ion (H+) is enhanced by transition from oxyhemoglobin to deoxyhemoglobin, allowing deoxyhemoglobin to take up much of the H+ generated from spontaneous dissociation of carbonic acid. By modifying hemoglobin oxygen affinity, carbon dioxide also facilitates respiratory gas exchange in the lungs. At the lungs, carbon dioxide is given up by red blood cells into the alveoli. Carbon dioxide concentration falls, thereby shifting the oxygen equilibrium curve to the left; the increase in hemoglobin oxygen affinity enhances uptake of oxygen from the alveoli.30 The combined effects of pH, Pco2, and temperature on the oxygen equilibrium curve can be viewed, in theory, as advantageous for species survival. An increase in tissue metabolism causes increases in local temperature, H+ concentration, and Pco2, all of which raise P50. The result is a higher gradient of oxygen tension between the capillary and the mitochondrion at the site (tissue) where oxygen consumption is highest. For example, the in vivo oxygen equilibrium curve has been shown to shift markedly rightward during acute exercise as a result of combined Bohr and temperature effects.31
It has long been recognized that the oxygen affinity of hemoglobin A in free solution is considerably greater than that of the intact fresh erythrocyte. In 1967, it was demonstrated that interaction with a number of organic phosphates decreased the affinity of a hemoglobin solution for oxygen, with 2,3-DPG being the most effective.32,33 Of the organic phosphates normally found in the human erythrocyte, 2,3-DPG is present in the largest concentrations and thus is both qualitatively and quantitatively the most important phosphate with respect to modulation of hemoglobin oxygen affinity. Hemoglobin oxygen affinity as indicated by P50 is linear with respect to 2,3-DPG concentration over a wide range; a change of 0.43 mmol of 2,3-DPG/mL of red blood cells results in a 1-mm Hg change in P50.34 The highly negatively charged 2,3-DPG anion binds preferentially to deoxyhemoglobin in a 1 : 1 molar ratio under physiologic conditions of solute concentration and pH. On a molecular basis, 2,3-DPG decreases oxygen affinity by stabilizing the quaternary structure of deoxyhemoglobin through cross-linking of β-chains. A second mechanism by which 2,3-DPG reduces oxygen affinity is by altering the intraerythrocytic pH relative to plasma pH. The reduction in pH consequently decreases oxygen affinity by the Bohr effect.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323352147000718
The Molecular Basis of Genetic Disease : General Principles and Lessons from the Hemoglobinopathies
Robert L. Nussbaum MD, FACP, FACMG, in Thompson & Thompson Genetics in Medicine, 2016
Hemoglobins with Altered Oxygen Affinity.
Mutations that alter oxygen affinity demonstrate the importance of subunit interaction for the normal function of a multimeric protein such as hemoglobin. In the Hb A tetramer, the α:β interface has been highly conserved throughout evolution because it is subject to significant movement between the chains when the hemoglobin shifts from the oxygenated (relaxed) to the deoxygenated (tense) form of the molecule. Substitutions in residues at this interface, exemplified by the β-globin mutantHb Kempsey (seeTable 11-3), prevent the normal oxygen-related movement between the chains; the mutation “locks” the hemoglobin into the high oxygen affinity state, thus reducing oxygen delivery to tissues and causing polycythemia.
Molecular Hematopathology
Rong He MD, … David S. Viswanatha MD, in Hematopathology (Third Edition), 2018
High Oxygen-Affinity Hemoglobin Variants
High oxygen-affinity hemoglobin variants are defined by an associated left-shifted oxygen dissociation curve (decreased p50 value), and more than 300 different mutations have been reported. Usually these are the result of point mutations or small deletions involving loci important in cooperative binding of α and β subunits, the heme pocket, the binding of 2,3-BPG, or C-terminal conformation stabilization; approximately one third of known high oxygen-affinity variants are associated with clinically evident erythrocytosis. The remaining high oxygen-affinity variants are not associated with erythrocytosis for various reasons, most often owing to a decreased amount of the variant hemoglobin (unstable or α chain variants). The degree of erythrocytosis owing to a high oxygen-affinity hemoglobin variant is usually proportional to the degree of p50 decrease; however, compound heterozygotes with concurrent β thalassemia can show a more severe polycythemia than expected. The erythrocytosis is EPO driven, and serum EPO levels are usually inappropriately normal but can be elevated. If notation of erythrocytosis is forwarded as an indication for testing, a thorough hemoglobin electrophoresis evaluation by an experienced laboratory will identify the majority of abnormal hemoglobin variants. It is important to note that a significant subset of high oxygen-affinity variants do not resolve from normal hemoglobins by conventional methods; therefore, mass spectrometry and/or sequencing of the β and α globin genes (discussed earlier) is warranted in negative cases to exclude these electrophoretically silent variants. Correlation of the molecular data is crucial for correct classification as the quantity of variant can affect the clinical phenotype and quantitation requires protein evaluation.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323479134000240
Hemoglobin Vesicles as a Molecular Assembly: Characteristics of Preparation Process and Performances as Artificial Oxygen Carriers
Hiromi Sakai, … Eishun Tsuchida, in Blood Substitutes, 2006
REGULATION OF OXYGEN AFFINITY
The O2 affinity of purified Hb (expressed as P50, the O2 tension at which Hb is half-saturated with O2) is about 14 mmHg, and Hb strongly binds O2 and does not release O2 at 40 mmHg (the partial pressure of mixed venous blood). Historically, it has been considered that the O2 affinity should be regulated to a level similar to that of RBC, namely about 25–30 mmHg, using an allosteric effector or by a direct chemical modification of the Hb molecules. Theoretically, this allows sufficient O2 unloading during blood microcirculation, as can be evaluated by the arteriovenous difference in the levels of O2 saturation in accordance with an O2 equilibrium curve. It has been supposed that decreasing the O2 affinity (increasing P50) will result in an increase in the O2 unloading, which is supported by the result that RBC with a high P50 shows an enhanced O2 release for improved exercise capacity in a mouse model (Shirasawa et al., 2003).
If this theory is correct, the P50 of Hb in HbV should be equivalent to that of human red blood cells, i.e., 28 mmHg, or higher. Pyridoxal 5 — phosphate (PLP) is co-encapsulated in HbV as an allosteric effector to regulate P50 (Sakai et al., 2000b). The main binding site of PLP is the N-terminal of the α- and β-chains and β-82 Lysine within the β-cleft, which is part of the binding site of natural allosteric effector, 2,3-diphosphoglyceric acid (2,3-DPG). The bound PLP retards the dissociation of the ionic linkage between the β-chains of Hb during conversion of deoxy to oxyHb in the same manner as does 2,3-DPG. Thus the O2 affinity of Hb decreases in the presence of PLP. The P50 of HbV can be regulated to 5–150 mmHg by co-encapsulating the appropriate amount of PLP or inositol hexaphosphate as an allosteric effector (Wang et al., 1992). Equimolar PLP to Hb (PLP/Hb = 1/1 by mol) was co-encapsulated, and P50 was regulated to 18 mmHg. When the molar ratio PLP/Hb was 3/1, P50 was regulated to 32 mmHg. The O2 affinities of HbV can be regulated quite easily without changing the other physical parameters, whereas in the case of the other modified Hb solutions their chemical structures determine their O2 affinities and thus regulation is difficult. The appropriate O2 affinities for O2 carriers have not been yet completely decided; however, the easy regulation of the O2 affinity may be useful in meeting the requirement for clinical indications such as oxygenation of ischemic tissues (Contaldo et al., 2003).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012759760750055X
Investigation of Variant Haemoglobins and Thalassaemias
Barbara J. Wild, Barbara J. Bain, in Dacie and Lewis Practical Haematology (Twelfth Edition), 2017
Haemoglobins with altered oxygen affinity
Haemoglobin variants with altered oxygen affinity are a rare group of variants that result in increased or reduced oxygen affinity.5 Mutations that increase oxygen affinity are generally associated with benign lifelong erythrocytosis. This may be confused with polycythaemia vera and in the past has been inappropriately treated with cytotoxic drugs and 32P.
Haemoglobin variants with decreased oxygen affinity are, with the exception of haemoglobin S, even less common and are usually associated with mild anaemia and cyanosis. However, owing to the reduced oxygen affinity, these patients are not functionally anaemic despite the reduced haemoglobin concentration (Hb). The low steady-state Hb in haemoglobin S homozygotes is, to a considerable extent, a result of its reduced oxygen affinity.
Measurement of oxygen dissociation is described on p. 251.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978070206696200014X
The Structural and Functional Properties of Hemoglobin and their Relevance for a Hemoglobin-Based Blood Substitute
Andrea Bellelli MD, Maurizio Brunori MD, in Blood Substitutes, 2006
NON-HEME LIGANDS: H+, Cl−, CO2 AND 2,3-DPG
The O2 affinity of Hb is lowered by several substances that combine at sites other than the heme and are collectively identified as allosteric effectors or heterotropic ligands. Physiologically, the most important heterotropic ligands are H+, Cl−, CO2 and 2,3-diphosphoglycerate (2,3-DPG). The effect of heterotropic ligands is part of the quaternary control of O2 affinity, since they bias the allosteric equilibrium, usually in favor of the T state.
The modulation of O2 affinity by H+ is known as the Bohr effect, and reflects (1) the release of protons upon oxygenation at physiological pH (the alkaline Bohr effect), or (2) uptake of protons upon oxygenation at pH values below ~6 (the acid or reverse Bohr effect). The alkaline Bohr effect is relevant not only to O2 transport, but also to the blood’s buffer capacity. To a very crude approximation, each subunit behaves as a weak acid with pKa ~ 7.6 in deoxyHbA and pKa ~ 6.7 in oxyHbA; as a consequence of such a change of pKa, binding of one mole of O2 causes the release of 0.5 moles of hydrogen ion (Antonini and Brunori, 1971). However, it became clear very early on that an accurate description of the Bohr effect demands more ionizable groups with subtler changes of pKa, and an obvious goal of subsequent research was the identification of the Bohr residues.
The amino-acid residues capable of binding H+ are numerous in the protein structure, but those that effectively do so at physiological pH are only a handful; the most relevant for physiology are Valine NA1(1)α and Histidine HC3(146)β, both involved in the network of C-terminal salt bridges stabilizing THb. The shape and amplitude of the Bohr effect (i.e., the ratio H+/O2) depend strongly on the experimental conditions, and especially on the concentration of chloride ions (Bucci and Fronticelli, 1985); hence it is often difficult to compare experiments carried out in different laboratories. The α amino group of Valine NA1(1)α accounts for 25 per cent of the alkaline Bohr effect in 0.1 M Cl−, whereas the imidazole group of Histidine HC3(146)β is responsible for 50 per cent of the alkaline Bohr effect under the same experimental conditions (Kilmartin and Rossi Bernardi, 1973; Riggs, 1988) and for almost all the Bohr effect observed in the absence of chloride. These estimates were challenged by Chien Ho, who, on the basis of NMR measurements, suggested that a larger number of residues, each experiencing much smaller pKa changes, should be considered (Ho and Russu, 1987); however, the assignment of proton resonances is difficult and these results are controversial (Riggs, 1988 and references therein).
Carbon dioxide combines with the N terminal amino groups of both chains to form a carbamino-derivative (Kilmartin and Rossi Bernardi, 1973), and decreases the O2 affinity and the Bohr effect (Imaizumi et al., 1982). Under physiological conditions Hb plays a comparatively minor role in the transport of CO2, since over 90 per cent of this gas is physically dissolved in the blood as bicarbonate; moreover the affinity of HbA for CO2 is relatively low, especially in view of its competition with chloride (i.e., Kd = 70 mmHg at pH = 7.4 and T = 25°C, from the data of Imaizumi et al., 1982, to be compared with a physiological partial pressure of ∼ 44 mmHg).
2,3-DPG in humans exerts the most effective control of O2 affinity (Benesch and Benesch, 1969). It is produced by the erythrocytic enzyme glycerate bis-phosphate mutase, which uses as a reagent the glycolysis metabolite glycerate 1,3-diphosphate. 2,3-DPG binds to a specific site between the chains and lowers the O2 affinity of Hb by a factor of 3.5 (pH = 7.5, T = 20°C and [Cl−] = 0.1 M; data of Antonini et al., 1982) by two simultaneous effects: it decreases the intrinsic O2 affinity of T-state Hb and it stabilizes this allosteric state so that conversion to the R state occurs at a higher degree of O2 saturation. 2,3-DPG binds in a cavity on the dyad axis of the tetramer, limited by the amino termini and helices H of the β subunits; it makes hydrogen bonds with Valine NA1(1), Histidine NA2(2), Lysine EF6(82), and Histidine H21(143) (Perutz, 1970). The affinity of 2,3-DPG is Kd = 3.8 mM for HbO2 and Kd = 0.024 mM for Hb (conditions as above; data of Antonini et al., 1982).
When Hb is extracted from the red cells, modified, and infused as a solution, 2,3-DPG is separated and lost in the purification procedures or because of renal filtration; as a consequence Hb solutions have a higher O2 affinity than red cells. Several chemical modifications of Hb were devised to reduce its O2 affinity in order to mimic the value in the erythrocyte.
Other allosteric effectors exist, and some of them are relevant to the physiology of O2 transport. By far the most important is chloride, the concentration of which in the blood is almost constant at 0.1 M. Chloride, besides being an effector by itself, participates to the Bohr effect (see above and Bucci and Fronticelli, 1985).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780127597607500391
Hemoglobin
N.V. BHAGAVAN, in Medical Biochemistry (Fourth Edition), 2002
Secondary Polycythemia Syndromes
Mutations thatincrease oxygen affinity (reduce P50) can decrease tissue oxygenation more than expected on the basis of hemoglobin concentration. At low oxygen tension, production of erythropoietin is stimulated, causing a secondary polycythemia that increases oxygen delivery to the tissues and partially compensates for the hemoglobin abnormality.
Any mutation that stabilizes the R (oxy) state (Hb Chesapeake) or destabilizes the T (deoxy) state (Hb Kempsey) can cause polycythemia. More than 28 such variants are known. Fourteen of these high-affinity hemoglobins have mutations at the α1β2 interface. Because the C terminus of the β chain supplies a hydrogen bond that is important for stabilizing the T-state, its replacement (Hb Bethesda), deletion (Hb McKees Rocks), or alteration in its environment (Hbs Syracuse and Cowtown) markedly decreases P50. Hb San Diego is unique in having high oxygen affinity due to a substitution in the α1β1 interface. Mutations that decrease the stability of the hemoglobin and cause precipitation or dissociation can also increase oxygen affinity.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780120954407500305

