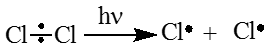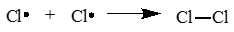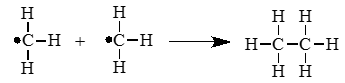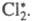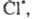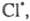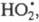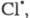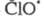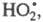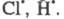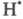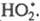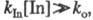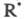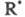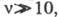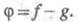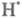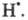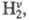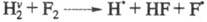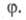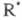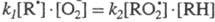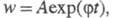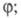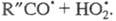Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары.
Образующиеся при этом частицы — это свободные радикалы.
A:B → A∙ + ∙B
Гомолитический разрыв связи характерен для слабо полярных или неполярных связей.
Условия протекания радикальных реакций:
- Повышенная температура;
- Неполярный растворитель или отсутствие растворителя
- Реакция протекает под действием света или ультрафиолетового излучения
- В системе присутствуют свободные радикалы или источники свободных радикалов.
Например, взаимодействие метана с хлором протекает по цепному радикальному механизму.
То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Этапы радикально-цепного процесса:
Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы:
Cl:Cl → Cl⋅ + ⋅Cl
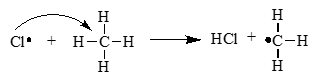
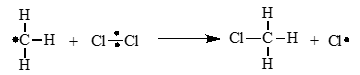
Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора:
CH4 + ⋅Cl → CH3⋅ + HCl
CH3⋅ + Cl2 → CH3Cl + ⋅Cl
Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
CH3⋅ + ⋅CH3 → CH3CH3
CH3⋅ + ⋅Cl → CH3Cl
Гетеролитический (ионный) разрыв связи – это такой разрыв химической связи, когда один из атомов получает при разрыве общую электронную пару.
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион.
A:B → A:– + B+
Если на атоме углерода сосредоточен отрицательный заряд, то такой анион называют карбоанионом.
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей.
Условия протекания ионных реакций:
- Относительно невысокая температура;
- Использование полярного растворителя;
- Использование катализатора.
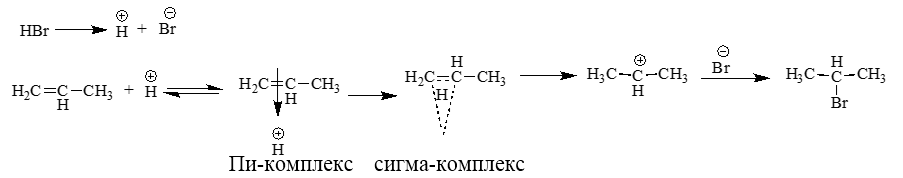
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом:
CH2=CH2 + HBr → CH3-CH2Br
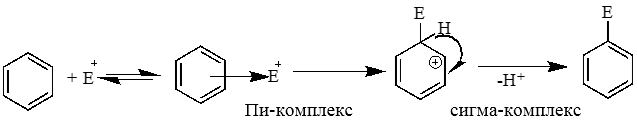
Реакция протекают по механизму электрофильного присоединения в несколько стадий.
I стадия. Электрофилом является протон Н+ в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион. На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд:
II стадия. Карбокатион взаимодействует с анионом Br–:
При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество.
Например, при присоединении бромоводорода к этилену образуется только бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при взаимодействии полярных молекул типа НХ с несимметричными алкенами водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве:
CH2=CH-CH3 + HCl → CH3-CHCl-CH3
В некоторых случаях присоединение к двойным связям происходит против правила Марковникова.
Исключения из правила Марковникова:
1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи.
Например, при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода:
Сl-CH2-CH=CH2 + HCl → Cl-CH2-CH2-CH2Cl
2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова.
Например, при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан:

|
kr = |
k 2 k a0 |
γ A γ B |
|
|
γ |
≠ |
||
γ ≠≈const , т. к. [AB]≠ очень мала. Взаимодействие между ионами и молекулами: AzA + BzB <==ka0==> [ABzA+zB]≠ → k2 → прод
|
kr = |
k 2 k a0 |
γ A γ B |
|
|
γ |
≠ |
||
В случае электролитов: lg γ i=−A z2i √I .
В предельно разбавленных растворах все коэффициенты γ стремятся к 1. kr =k2 k0a =k0
k0 – это константа скорости ион-ионного или ион-дипольного взаимодействия в бесконечно разбавленном растворе.
lg kr=lg k 0+[lg γ A+lg γ B−lgγ ≠ ]=lg k0 −A √I [ z2A+z2B−(zA+ zB)2 ]=lg k 0+2 A zA zB √I
lg kr =2 A zA zB √I — уравнение Бренстеда-Бьеррума. k0
График в координатах lg kr/k0 — √I – прямая линия. Направление и угол наклона прямой определяется знаком и величиной zAzB (+ — вверх, — — вниз, 0 — горизонтальная (для молекул)).
Влияние ионной силы раствора на константу скорости химической реакции называется первичным солевым эффектом.
Влияние ионной силы раствора на константу скорости межионного взаимодействия называется вторичным солевым эффектом. Он обусловлен тем, что в выражение для константы скорости входят активности молекул, которые зависят от концентрации.
Влияние растворителя на скорость реакций
Влияние обусловлено в первую очередь тем, что изменяется энергетика сольватации. Сольватация — процесс экзотермический, следовательно, он должен приводить к уменьшению энергии активации. Сольватация понижает энергию веществ, поэтому, если сольватированы исходные вещества, то реакция протекает хуже (нужно больше энергии), а если сольватирован активированный комплекс, то она протекает лучше (нужно меньше энергии) по сравнению с газовой фазой.
Цепные реакции
Цепные реакции — это процессы, в которых превращение исходных веществ в продукты осуществляется за счет чередования нескольких реакций с участием свободных радикалов.
Основные экспериментальные признаки цепных реакций:
1)активирующее действие (поглощение кванта ЭМИ) вызывает многократный ответ (в продукты превращается более одной частицы исходного вещества);
2)скорость цепных реакций сильно зависит от формы и размеров реакционного сосуда (S/V);
3)процесс очень чувствителен к добавкам посторонних веществ, которые относятся к устойчивым радикалам;
4)очень часто порядок реакции не целочисленный и кратен ½.
Т.к. свободные радикалы имеют неспаренный электрон, их взаимодействие с «четными» молекулами (без неспаренных электронов) обязательно будет давать новую частицу, содержащую неспаренный электрон, поэтому активные центры всегда сохраняются, они могут быть уничтожены вследствие двух реакций:
1)взаимодействие двух радикалов, которое дает устойчивую молекулу;
2)за счет адсорбции активных частиц на поверхности реакционного сосуда.
Основные стадии цепной реакции
1. Зарождение цепи
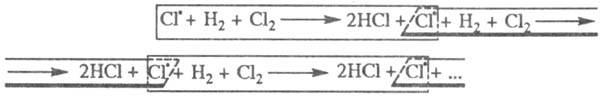
Cl2 → hv → Cl* + *Cl *-электрон
В результате какого-либо воздействия (ЭМИ, термическое) возникают активные частицы, содержащие неспаренный электрон.
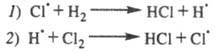
2.Развитие (продолжение) цепи Cl* + H2 → HCl + H*
H* + Cl2 → HCl + Cl* Cl* + H2 → HCl + H* …
3.Обрыв цепи
1) Cl* + стенка → Clадс
r ~ [Cl*] — линейный обрыв цепи 2) Cl* + Cl* → Cl2
r ~ [Cl*]2 – квадратичный обрыв цепи
Влюбой цепной реакции одновременно идут оба механизма. При малых концентрациях Cl* преобладает линейный обрыв, при высоких — квадратичный.
Взависимости от числа активных частиц, которые образуются в элементарном акте, в цепные реакции делятся на 2 класса:
1)неразветвленные цепные реакции — из одного радикала образуется один радикал;
2)разветвленные цепные реакции — из одного радикала образуется несколько радикалов.
Звено цепи — это совокупность последовательных элементарных актов, из повторения которых складывается цепной процесс.
Длина цепи — это среднее число полных звеньев на стадии продолжения или развития цепи. Длина цепи — это отношение числа молекул продуктов реакции к числу первоначально возникших активных частиц. Она может быть определена как отношение скорости развития цепи к скорости ее обрыва. Она зависит от давления, формы и размера сосуда (S/V), присутствия посторонних веществ, относящихся к ингибиторам цепных реакций.
Кинетическое уравнение для неразветвленной цепной реакции
Метод вывода основан на методе стационарных концентраций.
H2 + Br2 → 2HBr Экспериментальное уравнение:
|
d [ HBr] |
= ka [ H 2][Br 2 ]1/ 2 . |
|||
|
dt |
k b+ |
[ HBr ] |
||
|
[ Br2 ] |
1)Br2 → k1 → 2Br*
2)Br* + H2 → k2 → HBr + H* H* + Br2 → k3 → HBr + Br*
3)H* + HBr → k4 → H2 + Br*
4)Br* + Br* → k5 → Br2
|
r= |
d [HBr ] |
=k 2 [Br *][ H 2 ]+k3 [ H *][ Br2 ]−k 4 [ H *][ HBr] |
|||||||||||||||||||||||||||||||||||||||||||||
|
dt |
|||||||||||||||||||||||||||||||||||||||||||||||
|
0= |
d [H *] |
=k2 [ Br *][ H 2 ]−k3 [H *][ Br2 ]−k 4 [ H *][HBr ] |
|||||||||||||||||||||||||||||||||||||||||||||
|
dt |
|||||||||||||||||||||||||||||||||||||||||||||||
|
0= d [Br *]=k1 [ Br2 ]−k 2 [ Br *][ H 2]+k3 [ H *][ Br2 ]+k4 [ H *][ HBr ]−k5 [ Br *]2 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
dt |
|||||||||||||||||||||||||||||||||||||||||||||||
|
d [H *] |
d [ Br *] |
2 |
*]=√ |
k 1 |
|||||||||||||||||||||||||||||||||||||||||||
|
dt |
+ |
dt |
=0=k1 |
[Br 2]−k5 [ Br *] [ Br |
[ Br2 ] |
||||||||||||||||||||||||||||||||||||||||||
|
k 5 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
d [ H *] |
[ H 2 ]√ |
k1 |
|||||||||||||||||||||||||||||||||||||||||||||
|
=0=k2 |
[ Br2 ]−k 3[H *][ Br2 ]−k 4 [ H *][HBr ] |
||||||||||||||||||||||||||||||||||||||||||||||
|
dt |
k5 |
||||||||||||||||||||||||||||||||||||||||||||||
|
k2 [ H 2 ]√ |
k |
||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
[ Br2 ] |
||||||||||||||||||||||||||||||||||||||||||||||
|
[ H *]= |
k5 |
||||||||||||||||||||||||||||||||||||||||||||||
|
k3 [Br 2 ]+k 4 [ HBr] |
|||||||||||||||||||||||||||||||||||||||||||||||
|
k 2 [ H 2]√ |
k |
||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
[ Br2 ] |
||||||||||||||||||||||||||||||||||||||||||||||
|
√ |
k1 |
||||||||||||||||||||||||||||||||||||||||||||||
|
d [ HBr]=k 2 [ H 2 ] |
[Br 2]+ |
k 5 |
(k |
3[ Br2 ]−k 4 [ HBr ]) |
|||||||||||||||||||||||||||||||||||||||||||
|
k |
k [ Br ]+k [ HBr |
] |
|||||||||||||||||||||||||||||||||||||||||||||
|
dt |
5 |
||||||||||||||||||||||||||||||||||||||||||||||
|
3 2 4 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
=A |
|||||||||||||||||||||||||||||||||||||||||||||||
|
k 2 [ H 2 ]√ |
k 1 |
||||||||||||||||||||||||||||||||||||||||||||||
|
= A(k3 [ Br2 ]+k4 [ HBr ]+k3 [ Br2 ]−k4 [HBr ])= |
[Br 2] 2 k 3 |
[Br 2 |
] |
||||||||||||||||||||||||||||||||||||||||||||
|
d [ HBr] |
k 5 |
/:[ Br2 ] |
|||||||||||||||||||||||||||||||||||||||||||||
|
dt |
|||||||||||||||||||||||||||||||||||||||||||||||
|
k 3 [ Br2 ]+k4 [ HBr] |
|||||||||||||||||||||||||||||||||||||||||||||||
|
2 ]√ |
k |
||||||||||||||||||||||||||||||||||||||||||||||
|
2 k2 k3 [H |
1 |
[ Br2 ] |
|||||||||||||||||||||||||||||||||||||||||||||
|
d [ HBr] = |
k 5 |
||||||||||||||||||||||||||||||||||||||||||||||
|
[HBr ] |
|||||||||||||||||||||||||||||||||||||||||||||||
|
dt |
k3+k |
4 |
|||||||||||||||||||||||||||||||||||||||||||||
|
[Br 2 ] |
Нахождение длины цепи неразветвленной цепной реакции
Развитие цепи:
Br* + H2 → k2 → HBr + H* — основная H* + Br2 → k3 → HBr + Br*
Br* + Br* → k5 → Br2 — обрыв

|
ν = |
k 2 [ Br *][ H2 ] |
= |
k2 [ H 2 ] |
|||
|
2 |
||||||
|
k |
k5 √ |
k |
||||
|
[ Br *] |
||||||
|
5 |
1 |
[Br 2 |
] |
|||
|
k5 |
Длина цепи данной реакции зависит от [H2], меньше зависти от [Br2], от k2, k5 и от КД брома.
Разветвленные цепные реакции
В разветвленных цепных реакциях в элементарном акте возникает более одной активной частицы.
|
n |
f>g |
g – константа скорости обрыва цепи |
|
f – константа скорости развития цепи |
||
Неразв.Разветвленные цепные реакции протекают очень быстро, часто сопровождаются вспышками и
g>f взрывами. С ростом температуры или давления, изменения отношения S/V скорость таких реакций
возрастает скачкообразно, а не плавно.
τ
Кинетическое уравнение для разветвленной цепной реакции r= dndt =v0 + fn−gn , v0 – начальная скорость
1) g >> f
dndt =v0− gn
|
n |
dn |
t |
|
|
∫ |
= dt |
||
|
v0−gn |
∫ |
||
|
0 |
0 |
−ln(v0−gn)+ln v0=g t
−ln v0 −gn =g t v0
v0− gn=e−g t v0
n= vg0 [1−e−gt ]
2) g << f
dndt =v0+ fn
|
n |
dn |
t |
|
|
∫ |
= dt |
||
|
v0+ fn |
∫ |
||
|
0 |
0 |
ln(v0+ fn)+ln v0= f t
ln v0+ fn= f t v0
v0+ fn =e f t v0
n= vf0 [e f t −1]
Задание № 19135
Установите соответствие между схемой процесса и стадией цепной реакции, на которой происходит этот процесс. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ПРОЦЕССА
А) СН4 + Сl• → СН3• + НСl
Б) •CH3 + •СН3 → СН3-СН3
В) Сl2 → 2Сl•
Г) •CCl3 + Cl• → ССl4
СТАДИЯ ЦЕПНОЙ РЕАКЦИИ
1) зарождение цепи
2) развитие цепи
3) обрыв цепи
Показать ответ
Комментарий:
СН4 + Сl• → СН3• + НСl — рост (развитие) цепи.
•CH3 + •СН3 → СН3-СН3 — обрыв цепи.
Сl2 → 2Сl• инициирование (зарождение) цепи.
•CCl3 + Cl• → ССl4 — обрыв цепи.
Ответ: 2313
Нашли ошибку в задании? Выделите фрагмент и нажмите Ctrl + Enter.
Содержание
- Цепная реакция
- Химические цепные реакции
- Ядерные цепные реакции
- Лекция 26
- Теория обрыва цепей разработана Н.Н. Семёновым.
- Разветвлённые цепные реакции
Цепная реакция
Цепная реакция представляет собой последовательность реакций , в которых реакционный продукт или побочный продукт вызывают дополнительные реакции. В цепной реакции положительная обратная связь приводит к саморасширяющейся цепочке событий .
Цепные реакции — это один из способов, при котором системы, находящиеся в термодинамическом неравновесном состоянии, могут высвобождать энергию или увеличивать энтропию, чтобы достичь состояния с более высокой энтропией .
Например, система не может быть в состоянии достичь более низкого энергетического состояния, выделяя энергию в окружающую среду, поскольку она каким-то образом препятствует или препятствует прохождению пути, который приведет к высвобождению энергии.
Если реакция приводит к небольшому энерговыделению, позволяющему высвобождать больше энергии в расширяющейся цепочке, то система, как правило, разрушается взрывом до тех пор, пока большая или вся запасенная энергия не будет освобождена.
Таким образом, макроскопическая метафора цепных реакций представляет собой снежный ком, вызывающий больший снежный ком, пока, наконец, не произойдет лавинный эффект (« эффект снежного кома »).
Это результат накопленной гравитационной потенциальной энергии, ищущей путь высвобождения по трению. Химически эквивалент снежной лавине — это искра, вызывающая лесной пожар.
В ядерной физике одиночный беспризорный нейтрон может привести к быстрому критическому событию, которое может, наконец, оказаться достаточно энергичным для ядерного взрыва или (в бомбе) ядерного взрыва.
Химические цепные реакции
История
В 1913 году немецкий химик Макс Боденштейн впервые выдвинул идею химических цепных реакций.
Если две молекулы реагируют, образуются не только молекулы конечных продуктов реакции, но также некоторые нестабильные молекулы, которые могут далее взаимодействовать с исходными молекулами с гораздо большей вероятностью, чем исходные реагенты. В новой реакции помимо стабильных продуктов образуются и другие нестабильные молекулы и т. Д.
В 1918 году Вальтер Нернст предположил , что фотохимическая реакция водорода и хлора является цепной реакцией, чтобы объяснить большой квантовый выход , означающий, что один фотон света ответственен за образование целых 106 молекул продукта HCl. Он предположил, что фотон диссоциирует молекулу Cl2 на два атома Cl, каждый из которых инициирует длинную цепочку реакционных стадий, образующих HCl.
[attention type=yellow]
В 1923 году датские и голландские ученые Кристиан Кристиансен и Хендрик Энтони Крамерс в анализе образования полимеров указывали, что такая цепная реакция не должна начинаться с молекулы, возбуждаемой светом, но также может начинаться с того, что две молекулы, К тепловой энергии, как это было предложено ранее для инициирования химических реакций Ван-т-Гоффа .
[/attention]
Кристиансен и Крамерс также отметили, что если в одном звене реакционной цепи образуются две или более нестабильные молекулы , цепь реакции будет ветвиться и расти. В результате на самом деле происходит экспоненциальный рост, что приводит к взрывному увеличению скоростей реакций и даже к самим химическим взрывам. Это было первое предложение о механизме химических взрывов.
Количественная теория цепной химической реакции была создана советским физиком Николаем Семеновым в 1934 году. Семёнов поделился Нобелевской премией в 1956 году с сэром Кириллом Норманном Хиншелвудом , который независимо разработал многие из тех же количественных понятий.
Типичные шаги
Основными типами ступеней цепной реакции являются следующие типы.
- Инициирование (образование активных частиц или носителей цепи, часто свободных радикалов , на тепловой или фотохимической стадии)
- Распространение (может содержать несколько элементарных шагов в цикле, когда активная частица в результате реакции образует другую активную частицу, которая продолжает цепочку реакции, введя следующую элементарную стадию). Фактически активная частица служит катализатором для общей реакции цикла распространения. Частными случаями являются:
* Разветвление цепи (шаг распространения, который формирует более новые активные частицы, чем вход в стадию);* Перенос цепи (стадия распространения, в которой активная частица представляет собой растущую полимерную цепь, которая реагирует с образованием неактивного полимера, рост которого заканчивается, и активной небольшой частицы (такой как радикал), которая затем может реагировать с образованием новой полимерной цепи ).
- Прекращение (элементарная стадия, на которой активная частица теряет свою активность , например, путем рекомбинации двух свободных радикалов ).
Длина цепи определяется как среднее количество повторений цикла распространения и равно общей скорости реакции, деленной на скорость инициирования.
Некоторые цепные реакции имеют сложные уравнения скорости с дробным порядком или смешанной кинетикой порядка .
Подробный пример: реакция водород-бромин
Реакция H 2 + Br 2 → 2 HBr протекает по следующему механизму:
Br 2 → 2 Br • (термический) или Br 2 + hν → 2 Br • (фотохимический)Каждый атом Br является свободным радикалом, обозначаемым символом «•», представляющим собой неспаренный электрон.
- Распространение (цикл из двух этапов)
Br • + H 2 → HBr + H •H • + Br 2 → HBr + Br •Сумма этих двух этапов соответствует общей реакции H 2 + Br 2 → 2 HBr, причем катализатором является Br ·, который участвует в первой стадии и регенерируется на второй стадии. H • + HBr → H 2 + Br •Этот шаг специфичен для этого примера и соответствует первому шагу распространения в обратном направлении. Рекомбинации двух радикалов, соответствующих в этом примере инициации в обратном направлении.
Как можно объяснить с помощью стационарного приближения , тепловая реакция имеет начальную скорость дробного порядка (3/2) и полное уравнение скорости с двухчленным знаменателем ( кинетика смешанного порядка ).
Ядерные цепные реакции
Ядерная цепная реакция была предложена Лео Сциллардом в 1933 году, вскоре после открытия нейтрона, но более чем за пять лет до того, как ядерное деление было впервые обнаружено.
Силард знал химические цепные реакции, и он читал о ядерной энергии, производящей энергию, в которой участвуют высокоэнергичные протоны, бомбардирующие литий, продемонстрированные Джоном Кокрофтом и Эрнестом Уолтоном в 1932 году.
Теперь Силард предложил использовать нейтроны, теоретически полученные из определенных ядер Реакции в более легких изотопах, чтобы вызвать дальнейшие реакции в легких изотопах, которые дали больше нейтронов. Это теоретически привело бы к цепной реакции на уровне ядра.
Он не рассматривал деление как одну из этих реакций, производящих нейтроны, так как эта реакция не была известна в то время. Эксперименты, которые он предложил использовать бериллий и индий, потерпели неудачу.
Позднее, после того, как деление было открыто в 1938 году, Силард сразу осознал возможность использования нейтронного деления как особой ядерной реакции, необходимой для создания цепной реакции, пока деление также дает нейтроны.
В 1939 году Сильбард с Энрико Ферми доказал эту реакцию размножения нейтронов в уране. В этой реакции нейтрон плюс делящийся атом вызывает деление, приводящее к большему числу нейтронов, чем одно, которое было израсходовано в начальной реакции.
Так родилась практическая ядерная цепная реакция по механизму нейтронного деления ядер.
[attention type=red]
В частности, если один или несколько из произведенных нейтронов взаимодействуют с другими делящимися ядрами и они также подвергаются делению, то существует вероятность того, что макроскопическая общая реакция деления не прекратится, а продолжится по всему материалу реакции. Это тогда является самораспространяющейся и, таким образом, самоподдерживающейся цепной реакцией. Это принцип для ядерных реакторов и атомных бомб .
[/attention]
Демонстрация самоподдерживающейся цепной ядерной реакции была выполнена Энрико Ферми и другими, в успешной эксплуатации первого искусственного ядерного реактора Chicago Pile-1 в конце 1942 года.
Лекция 26
Оглавление
Основные понятия и стадии цепных реакций. 1
Неразветвлённые цепные реакции. 3
Теория обрыва цепей разработана Н.Н. Семёновым. 4
Разветвлённые цепные реакции. 5
Цепные реакции – это сложные превращения реагентов в продукты. Особенностью цепных реакций является их цикличность. Эта цикличность обусловлена регулярным чередованием реакций с участием активных центров. Этими активными центрами могут быть атомы и свободные радикалы с высокой реакционной способностью, а также ионы и возбуждённые молекулы.
Различают реакции с энергетическими и материальными цепями в зависимости от природы активных центров. В первом случае происходит возбуждение молекулы без разрыва связей. Во втором – гомолитический распад молекулы с образованием частиц с неспаренными электронами.
Примеров цепных реакций можно привести множество: взаимодействие водорода и углеводородов с хлором и бромом, термическое разложение озона, крекинг углеводородов, реакции полимеризации и поликонденсации, ядерные реакции.
Любая цепная реакция трёхстадийна. На первой стадии образуются исходные активные центры, т.е. происходит зарождение цепи.
Эти активные центры взаимодействуют со стабильными молекулами с образованием одной или нескольких активных частиц. Эта стадия имеет название стадии развития или продолжения цепи.
Наконец, две активные частицы могут рекомбинировать в стабильную молекулу, в результате чего цепь обрывается, поэтому эта стадия – стадия обрыва цепи.
Первая стадия – наиболее энергоёмкая и, как правило, инициируется квантом света, участием фотосенсибилизатора, либо неустойчивыми соединениями типа пероксидов и азосоединений, а также парами легколетучих металлов (натрий, ртуть и др.) и многими неорганическими соединениями.
Стадия развития цепи может включать в себя реакции продолжения и развития цепи. Энергии активации этих элементарных стадий невелики, поэтому они протекают со значительными скоростями. К этим реакциям относятся:
1. Взаимодействие атома или свободного радикала с молекулой реагента с образованием новых свободных радикалов;
2. Взаимодействие атома или свободного радикала с молекулой реагента с образованием нового радикала и продукта реакции;
3. Мономолекулярная изомеризация радикала;
[attention type=green]
4. Мономолекулярный распад свободного радикала с образованием нового радикала и продукта;
[/attention]
5. Взаимодействие свободных радикалов с образованием нового радикала и продукта.
Если на стадии развития цепи протекают реакции, в результате которых число активных центров вырастает, то говорят о разветвлении цепей.
И, наконец, стадии обрыва цепи, это элементарные стадии, приводящие к исчезновению свободной валентности. Обрыв цепи может быть гомогенным (с участием инертной частицы) или гетерогенным (взаимодействие радикалов со стенкой реактора).
Следует иметь в виду, что рекомбинация радикалов в объёме без участия третьей частицы невозможна, т.к.
образованная молекула будет находиться в возбуждённом состоянии и требуется «отбор» лишней энергии для стабилизации молекулы, полученной рекомбинацией радикалов.
Процессы обрыва цепи в объёме протекают при больших давлениях, и скорость обрыва будет иметь второй порядок по концентрациям активных центров. В этом случае обрыв цепи называют квадратичным.
В общем случае любую цепную реакцию можно представить в виде следующей схемы:
реагент + αХ → продукт + βY
Х и Y – активные центры.
α и β – целые числа большие или равные 0.
Исходя из этой схемы, стадии можно представить следующим образом:
α=0, β≠0 – зарождение цепи.
α=β – продолжение цепи.
α
звено цепи включает 2 элементарные реакции:
Сумма этих элементарных реакций приводит к молекулярной реакции. Число полных звеньев, приходящихся в среднем на каждый активный центр, образовавшийся в реакции зарождения цепи – средняя длина цепи. Так, в приведённой реакции:
В феноменологической (формальной) кинетике цепных реакций возможны два подхода.
[attention type=yellow]
Первый основан на решении дифференциальных и алгебраических уравнений, полученных на основе закона действующих масс и механизма данной цепной реакции.
[/attention]
Для неразветвлённых цепных реакций применим метод стационарных концентраций Боденштейна. Второй подход основан на вероятностном характере химических процессов вообще и цепных реакций в частности.
Любая активная частица, образовавшаяся в результате акта зарождения цепи, входит в цикл реакций продолжения цепи – звено цепи. При этом она реализует превращение молекул реагента в молекулы продукта и выходит из этого цикла в виде частицы, неотличимой от вошедшей в него.
Далее она либо участвует в следующем звене, либо выходит из цикла путём рекомбинации. Вероятность рекомбинации одинакова на любом его звене, т.е. она постоянна. Таким образом, процессы обрыва цепи – это процессы стохастические и могут быть охарактеризованы постоянным параметром – вероятностью обрыва цепи β.
Но поскольку на каждой стадии происходит либо обрыв цепи, либо продолжение, то очевидно, что вероятность продолжения цепи α=1-β.
Исходя из этого, средняя длина цепи может быть вычислена:
где rr – скорость роста цепи.
rf – скорость обрывацепи.
Очевидно, при β
Для цепных реакций ν сильно зависит от концентрации и чистоты реагентов, интенсивности света, температуры, материала ректора и его размеров.
https://www.youtube.com/watch?v=inKz3nsYlDU
Условием стационарности в неразветвлённых цепных реакциях является равенство скоростей инициирования и обрыва цепей:
r0=rf
Скорость реакции будет выражаться:
Для скорости изменения концентрации активных центров можно записать уравнение (при линейном обрыве цепи, т.е. при низких давлениях):
где g – удельная скорость обрыва цепи.
При n=0, t=0 и r0=const, g=const получаем:
Зависимость скорости реакции от времени примет вид:
где l – удельная скорость реакции продолжения цепи.
Из последнего уравнения видно, что при , т.е. устанавливается стационарный режим.
Теория обрыва цепей разработана Н.Н. Семёновым.
Различают диффузионную и кинетическую области реакции обрыва цепи. В кинетической области скорость обрыва определяется скоростью адсорбции частиц на стенке. Эта скорость пропорциональна и зависит от — вероятности захвата стенкой свободных радикалов (). Константа скорости обрыва цепи для цилиндрического сосуда рассчитывается по уравнению:
где D – коэффициент диффузии,
d – диаметр реактора,
— средняя скорость (арифметическая).
Если обрыв цепи обусловлен диффузией, то
В кинетической области:
Разветвлённые цепные реакции
Цепные реакции, включающие стадии зарождения, разветвления и обрыва цепи называются разветвлёнными. Это процессы окисления белого фосфора и фосфина, водорода и оксида углерода (IV).
Теория этих реакций разработана Н.Н. Семёновым и Хиншелвудом. Было показано, что при описании развития этих реакций система кинетических уравнений для активных центров может быть сведена к уравнению для активных центров одного вида.
В дифференциальном уравнении появляется член, учитывающий скорость образования активных центров.
где
После интегрирования получаем:
где gn – скорость гибели активных центров.
fn – скорость образования активных центров.
[attention type=red]
По аналогии с неразветвлёнными цепными реакциями можно получить выражение для скорости:
[/attention]
где l – удельная скорость реакции продолжения цепи.
Анализ этих уравнений показывает:
1.
а) t=0
т.е. в начальный момент n и r линейно зависят от t.
б)
и .
т.е. с течением времени устанавливается стационарный режим.
2. т.е.
и
т.е. по истечению некоторого времени, если скорость образования активных центров превышает скорость их гибели, скорость процесса экспоненциально возрастает и по завершению периода индукции заканчивается взрывом даже при постоянной температуре. В этом случае воспламенение обусловлено спонтанным ростом скорости реакции из-за быстрого размножения активных центров.
3. f=g
Тогда выражение для скорости после раскрытия неопределённости по правилу Лопиталя примет вид:
т.е. реакция протекает без воспламенения, часто с чрезвычайно малой скоростью.
Дифференциальное уравнение
для конкретных реакций можно получить, как было показано Н.Н, Семёновым, методом частично стационарных концентраций. Метод стационарных концентраций для цепных реакций неприменим, поскольку концентрация одного из активных центров существенно возрастает в ходе процесса. Так, при окислении водорода в соответствии с общепринятым механизмом можно считать:
, но
т.е. при определении скорости убыли атомарного водорода необходимо решить полное дифференциальное уравнение.
Анализ кинетических уравнений позволяет объяснить удивительные явления при окислении фосфора и водорода. Было обнаружено экспериментально, что при окислении воспламенение наблюдается только при определённых давлениях. Это можно показать графически.
В области с координатами точки А реакционная смесь не воспламеняется. Чтобы смесь воспламенилась, можно не только увеличить температуру до Т1, но и уменьшить давление до р1, т.е. для этих реакций наблюдается явление увеличения скорости реакции при уменьшении числа частиц в единице объёма, что противоречит закону действующих масс.
https://www.youtube.com/watch?v=zSNcWchxyiA
Эта закономерность объясняется следующим образом. При малых давлениях увеличивается длина свободного частиц и увеличивается вероятность обрыва цепи на стенках реактора, т.е. реакция переходит в стационарный режим:
при .
При давлениях в области воспламенения разветвление преобладает над обрывом, т.е.
и скорость процесса становится экспоненциальной. При дальнейшем увеличении давления возрастает вероятность квадратичного обрыва цепей, и система вновь переходит на стационарный режим.
Примером разветвлённой цепной реакции является реакция деления урана:
В результате реакции выделяется энергия и в форме теплоты передаётся в окружающую среду, но в каждом акте деления урана образуется в среднем 2,5 нейтрона, которые «размножаются» в геометрической прогрессии и приводят к лавинообразному возрастанию числа делящихся атомов и к взрыву.
[attention type=green]
Отметим следующий факт. Мы рассмотрели пример, когда пределы воспламенения смеси Н2 + О2 не зависят от r0. Этот результат связан с тем, что реакции разветвления и обрыва цепей рассматриваются как линейные относительно концентрации активных центров, а квадратичные процессы не учитываются.
[/attention]
Однако эксперимент показывает, что увеличение скорости зарождения цепей приводит к значительному расширению области воспламенения гремучей смеси и к ускорению разветвления. В этом случае считают, что наблюдается положительное взаимодействие цепей.
Для скорости изменения концентраций с положительным взаимодействием цепей дифференциальное уравнение имеет вид:
где cn2 – скорость квадратичного разветвления цепей.
Принципиально от разветвлённых цепных реакций отличаются реакции с вырожденным разветвлением. Для них не наблюдается перехода в режим самовоспламенения и взрыва.
Рассмотрим окисление углеводородов. При низкотемпературном окислении на одной из стадий продолжения цепи образуется гидропероксид:
может стать источником свободных радикалов:
что приводит к возникновению новых цепей.
Когда степень превращения реагентов невелика и можно пренебречь убылью промежуточных продуктов, то кинетику этих реакций можно описать системой:
р – концентрация промежуточного продукта.
l – удельная скорость продолжения цепи.
Если (
Второе уравнение после интегрирования с граничным условием
при
даёт следующее выражение:
Если рассматривать квадратичный обрыв цепей, то система дифференциальных уравнений имеет вид:
В этом случае автоускорение выражено менее резко, чем для линейного обрыва цепей.
Невозможно запомнить все химические реакции и как они протекают, поэтому есть у каждой реакции свой механизм, по которому она протекает. Мы рассмотрим только те механизмы реакций, которые вам понадобятся в ЕГЭ, поэтому постарайтесь разобраться, именно разобраться, а не запомнить, почему так, а не по-другому.
Механизм реакции галогенирования алканов:
Реакция идет в три стадии:
-
Инициирование:
Молекула хлора расщепляется с образованием свободных радикалов.
Свободные радикалы — это атомы или группы атомов, с неспаренными электронами.
-
Рост цепи:
Радикал хлора взаимодействует с молекулой алкана, метильный радикал с новой молекулой хлора и т.д.
-
Обрыв цепи:
При присоединении двух радикалов друг с другом происходит обрыв цепи.
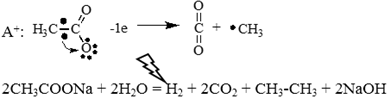
Механизм реакции Кольбе (электролиз водных растворов солей карбоновых кислот):
CH3COONa = CH3COO— + Na+
K—: 2H2O + 2e = H2 + 2OH—
Механизм реакции присоединения галогеноводородов (по правилу Марковникова):
Алкильные группа как электронодонорные заместители определяют место присоединения протона.
Метльная группа отталкивает электроны связи CH3-C, что приводит к поляризации пи-связи. Электроны этой связи являются очень подвижными, т.е. легко смещаются к атому углерода.
Против правила Марковникова:
Против правила Марковникова идет в том случае, если есть заместители с большой электроотрицательностью, либо в присутствии перекиси.
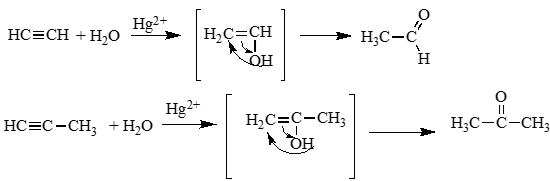
Механизм реакции Кучерова (гидратация алкинов):
Механизм электрофильного замещения:
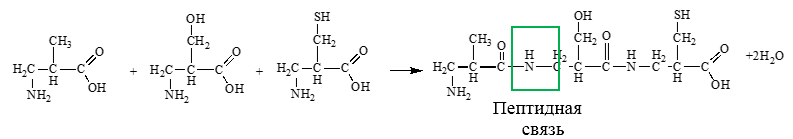
Схема образования пептидов:
ЦЕПНЫЕ РЕАКЦИИ
ЦЕПНЫЕ РЕАКЦИИ, хим. превращения
и ядерные процессы, в к-рых появление промежуточной активной частицы (свободного
радикала, атома, возбужденной молекулы в хим. превращениях, нейтрона —
в ядерных процессах) вызывает цепь превращений исходных в-в. Примеры хим.
цепных реакций- радикальная полимеризация, окисление, пиролиз и галогенирование
углеводородов и др. орг. соед.; ядерные цепные процессы — цепное деление
атомных ядер. Данная статья посвящена в основном химическим цепным реакциям.
Термин «цепные реакции» был предложен М. Боденштейном,
обнаружившим (1913), что в ряде фотохим. р-ций (напр., Н2 +
+ С12
2НС1, СО + С12
один поглощенный фотон вызывает превращение сотен тысяч молекул. Поскольку
согласно закону квантовой эквивалентности Штарка-Эйнштейна при поглощении
одного фотона в р-цию вступает лишь одна частица, остальные молекулы реагируют
без непосредственного светового воздействия. Боденштейн предположил, что
активной частицей, вызывающей цепь превращений, является возбужденная молекула
В 1916 В. Нернст высказал предположение об атомарной природе активных частиц
и предложил след, механизм цепных реакций с участием Сl2. Поглощение
фотона приводит к образованию из молекулы С12 двух атомов
к-рые вступают последовательно в р-ции:
Суммирование р-ций 7 и 2 дает брутто-р-цию,
к-рая отражает стехиометрию превращения Н2 + С12
Атом
образовавшийся в р-ции 2, идентичен атому
в р-цию 7, поэтому последовательность р-ций можно представить в виде, иллюстрирующем
наглядность термина «цепные реакции»:
Цепной механизм и его стадии
Цепные реакции относятся к сложным реакциям и
могут состоять из мн. элементарных стадий. Любая цепная реакция обязательно включает
три осн. стадии: инициирование (зарождение цепи), продолжение и обрыв цепи.
Инициированием наз. стадия, в к-рой из валентнонасыщенных молекул исходных
в-в образуются переносчики цепи- активные частицы, участвующие в последующих
р-циях и приводящие в конце концов к расходованию исходных в-в и образованию
продуктов (р-ции инициирования в дальнейшем обозначаются буквой i).
Последоват. р-ции (стадии) продолжения цепи составляют т. наз. цикл продолжения
цепи (ЦПЦ), или звено цепи, а число v звеньев, приходящихся в среднем
на каждый образовавшийся в р-ции инициирования переносчик цепи, наз. длиной
цепи. Переносчики цепи исчезают в р — циях обрыва цепи вследствие столкновений
друг с другом или со стенкой реакционного сосуда (в дальнейшем р-ции обрыва
обозначаются буквой о).
В нек-рых цепных реакциях в одной или неск. элементарных
стадиях происходит увеличение числа активных частиц, что приводит к разветвлению
цепей; такие цепные реакции наз. разветвленными.
Рассмотрим подробнее стадии цепных реакций.
Инициирование — наиб. энергоемкая
стадия цепной реакции, ее энергия активации определяется энергией разрываемой хим.
связи (обратная р-ция — безактивационная). Поэтому образование активных
частиц из молекул исходных в-в происходит лишь при достаточно высоких т-рах
или при воздействии света, ионизирующего излучения, ускоренных электронов
и т. п.
В отсутствие энергетич. воздействия образование
активных частиц и инициирование цепной реакции может происходить при обычных т-рах
лишь в присутствии инициаторов — в-в, в молекулах к-рых энергия разрыва
хим. связи существенно меньше, чем в молекулах исходных в-в. Типичные инициаторы
— орг. пероксиды и гидропероксиды, диазосоединения (см. Инициаторы радикальные).
Переносчики цепи образуются при последующих р-циях радикалов с молекулами
реагентов, напр.:
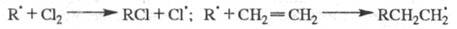
В газофазных системах инициирование может
протекать также на стенке сосуда S в результате диссоциативной хемо-сорбции
реагента, напр.:
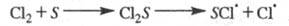
Энергия активации такой р-ции меньше, чем
р-ции в объеме на величину разницы теплот адсорбции
С12.
В р-рах инициирование может происходить
в результате переноса электронов, обычно в р-ции участвуют ионы переходного
металла. Инициатором мн. цепных реакций служит, напр., реактив Фентона H2O2
— FeSO4 (активные частицы
в р-ции
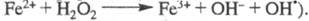
Инициаторы ускоряют образование активных
частиц, т. е. являются катализаторами инициирования, но в отличие от катализаторов
обычных (нецепных) процессов они расходуются (часто их наз. расходуемыми
катализаторами).
Продолжение цепи м. б. проиллюстрировано
на примере процессов фотохим. разложения Н2О2 в присут.
ионов Cu2+ и каталитич. разложения Н2О2
при добавлении в р-р ионов Fe3+, к-рые имеют схожие цепные механизмы
(переносчики цепи —
и Сu+ или Fe2+):
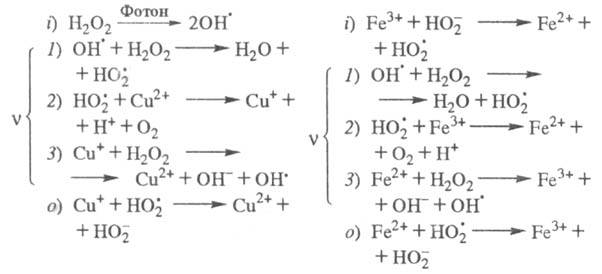
Представляют интерес р-ции ЦПЦ в нек-рых
важнейших пром. процессах. Так, для хлорирования орг. соединений ЦПЦ имеет
вид:
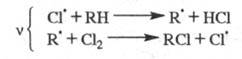
Для окисления орг. соединений:
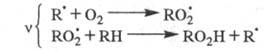
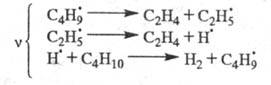
Для крекинга насыщенных углеводородов,
напр. бутана:
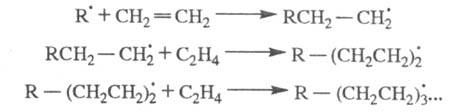
Для радикальной полимеризации олефинов:
Многие атмосферные процессы относятся к
цепным реакциям. Напр., в процессах соокисления метана и NO, образования H2SO4
в облачных каплях, содержащих
(кислотные дожди), ЦПЦ имеют вид:
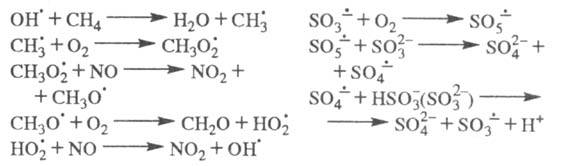
Стратосферные процессы разложения озона
под действием
также рассматриваются на основе представлений о цепных реакциях и их стадиях; в частности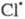
образуются из хладонов, их присутствие в стратосфере считается одним из
осн. факторов, ведущих к наблюдаемому уменьшению концентрации стратосферного
озона.
В период становления осн. понятий теории
цепных реакций в качестве активных частиц рассматривались лишь атомы и своб. радикалы.
В 30-х гг. Н. Н. Семенов предложил механизм цепных реакций с участием ион-радикалов
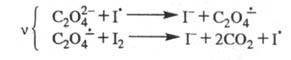
и возбужденных молекул. Так, для окисления щавелевой к-ты иодом предложена
след. цепь:
Для разложения озона предполагалась
цепь с участием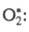
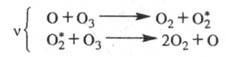
Впоследствии в число переносчиков цепи
вошли и др. частицы: бирадикал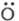
Н2), ионы переходных металлов в нестабильных (для условий опыта)
зарядовых состояниях, комплексные соед. в конформационно-неравновесных
состояниях и т. п. высокореакционные частицы.
Обрыв цепи. Гибель переносчиков
цепи при столкновениях со стенкой S реакционного сосуда происходит
по механизму типа: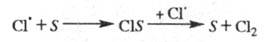
В этих случаях скорость р-ции обрыва пропорциональна
концентрации своб. радикалов — т. наз. линейный обрыв. Чем больше отношение
площади пов-сти сосуда к его объему, тем интенсивнее гибель переносчиков
цепи на стенке, тем короче цепь и меньше скорость р-ции.
Обрыв цепи вследствие столкновений радикалов
— переносчиков цепи друг с другом и взаимного насыщения своб. валентности
в объеме сосуда обычно происходит с участием третьей частицы М, роль к-рой
состоит в отводе энергии от образующейся частицы:
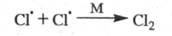
В этих случаях обрыв цепи является р-цией
второго порядка по концентрации своб. радикалов, а ее скорость пропорциональна
произведению их концентраций — т. наз. квадратичный обрыв.
Линейный обрыв цепи возможен и вследствие
хим. взаимод. переносчиков цепи с примесным в-вом, если при этом образуется
радикал, не участвующий в р-циях продолжения цепи. Так, переносчик цепи
с примесным О2 с образованием
к-рый не участвует в р-циях продолжения цепи и исчезает при столкновении
с др. частицей
или с атомами
Важнейший характерный признак цепных реакций- обрыв
цепей на молекулах ингибитора- в-ва, эффективно взаимодействующего с переносчиком
цепи и дезактивирующего его в результате хим. превращения. Выше упоминался
О2, дезактивирующий
переводом его в форму
В случае введения в хим. систему т. наз. слабого ингибитора цепная реакция длительное
время протекает медленнее, чем в его отсутствие. При добавке т. наз. сильного
ингибитора цепная реакция практически не наблюдается в течение нек-рого периода
индукции, после чего ее скорость становится такой же, как и без ингибитора
(подробнее см. в ст. Ингибиторы). В отд. группу выделяют ингибиторы
цепного окисления орг. в-в — т. наз. антиоксиданты. Эффективными
прир. антиоксидантами являются аскорбиновая к-та и токоферол.
Кинетические закономерности неразветвленных
цепных реакций.
В начальный момент времени концентрация
переносчиков цепи в реагирующей хим. системе равна нулю. При введении инициатора
или при энергетич. воздействии на систему начинается образование переносчиков
цепи со скоростью инициирования wi. Одновременно происходят
р-ции продолжения цепи, к-рые характеризуются относительно небольшими энергиями
активации, и практически безактивационный процесс обрыва цепи на стенке
или в объеме сосуда. Если р-ции на стенке являются основным каналом и инициирования
и обрыва цепи, то скорость цепной реакции не зависит от отношения площади пов-сти
сосуда S к его объему V, как и в том случае, если и инициирование
и обрыв цепи происходят в объеме; в иных случаях скорость цепной реакции зависит
от отношения S/V.
Обычно ЦПЦ состоит из 2-3 и более р-ций,
причем одна из них характеризуется большей (сравнительно с другими) энергией
активации и является скоростьопределяющей (лимитирующая стадия). Ее скорость
равна скоростям всех остальных р-ций ЦПЦ wпр, но концентрация
радикалов, участвующих в этой лимитирующей стадии, наибольшая. Т. к. гибель
радикалов является практически безактивационным процессом, то осн. вклад
в обрыв цепи вносят радикалы, участвующие в лимитирующей стадии ЦПЦ.
Участие переносчиков цепи в ЦПЦ не влияет
на их концентрацию в системе, т. к. в ЦПЦ происходит их регенерация. Число
переносчиков цепи п в единице объема в каждый момент времени t
в простейшем случае гибели на стенке выражается дифференц. ур-нием:

откуда

где g — т. наз. фактор гибели переносчиков
цепи (фактор обрыва цепи), равный константе скорости
kо
обрыва цепи на стенке. Из (2) следует, что
п = 0 при t =
0 и со временем п достигает значения
wi /kо.
Скорость цепной реакции w пропорциональна
п и возрастает от w = 0
до значения, определяемого выражением:

где [А] — концентрация реагента, подвергающегося
превращению по цепному механизму; kпр — константа
скорости продолжения цепи.
Различают два режима протекания процесса;
нестационарный, соответствующий периоду роста скорости w, и стационарный,
при к-ром п и w имеют постоянные значения. Характерные значения
kо — десятки с-1, поэтому, согласно (2), период
нестационарности характеризуется обычно долями секунды.
Если длина цепи v мала, в выражении
для скорости р-ции необходимо учесть скорость расходования реагентов в
стадии инициирования и скорость возможного образования продуктов в стадии
обрыва цепи. Обычно, однако, число v составляет десятки, сотни и
тысячи и скорость цепной реакции практически равна скорости каждой из р-ций продолжения
цепи, согласно выражению (3).
При введении ингибитора In возникает дополнит,
канал гибели переносчиков цепи (константа скорости
kIn)
и скорость цепной реакции принимает значение w’:
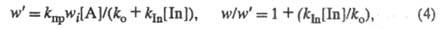
где [In] — концентрация ингибитора. Если
kIn невелика, для заметного замедления цепной реакции необходима
добавка ингибитора в такой концентрации [In], чтобы значения
kIn[In]
и ko были соизмеримы. Расход ингибитора будет происходить
со скоростью, меньшей wi, а т. к. его начальная концентрация
[In]0 -существенная величина, ее уменьшение в ходе р-ции м.
б. небольшим. Соответственно р-ция будет протекать длительное время со
скоростью, равной или близкой к значению, определяемому выражением (4),
где [In]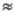
Если же константа скорости kIn велика настолько,
что уже при малых [In] о произведение
то в течение нек-рого времени, пока выполняется это неравенство, скорость
образования продукта будет ничтожно мала в сравнении со скоростью цепной реакции
w в отсутствие ингибитора. По мере расходования In, протекающего практически
со скоростью инициирования wi, скорость цепной реакции в присут.
ингибитора w’ достаточно быстро достигнет значения w.
Расчет скорости цепных реакций в общем случае производится
по методу квазистационарных концентраций (см. Квазистационарности приближение).
Этот метод применим к частицам, концентрации к-рых из-за высокой реакционной
способности на много порядков меньше концентраций реагентов. Для каждого
из переносчиков цепи
составляют дифференц. ур-ние, приравнивающее производную
к сумме скоростей всех р-ций, в к-рых
образуется и гибнет. Все производные полагают равными нулю и решают систему
алгебраич. ур-ний согласно методу Боденштейна.
Другой способ расчета скорости используют
для цепных реакций с длинами цепи
когда можно пренебречь возможным вкладом скоростей инициирования и обрыва
цепи в общую скорость р-ции, т. е. в тех случаях, когда общая скорость
w
равна скорости wпр р-ций ЦПЦ (все они имеют одинаковую
скорость) и wi = w0. Стационарную концентрацию
переносчиков цепи, участвующих в р-циях обрыва, определяют из кинетич.
ур-ния wi = w0 и затем рассчитывают
w. Так, для вышеупомянутого разложения Н2О2
в присуг. ионов Сu2+ при освещении светом интенсивности I
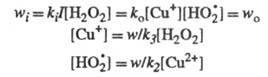
Отсюда
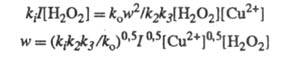
Разветвленные цепные реакции.
Термин предложен Н. Н. Семеновым для открытых
им (1926-28) цепных реакций с критич. явлениями, состоящими в том, что незначит.
изменения концентрации реагентов, т-ры, размеров сосуда, введение примеси
(даже разбавление реакционной смеси инертным газом) могут приводить к скачкообразному
росту скорости цепных реакций от практически ненаблюдаемой до столь большой, что
ее невозможно измерить. Впервые критич. явления в хим. системах были обнаружены
Семеновым, Ю. Б. Харитоном и 3. Ф. Вальта при окислении паров фосфора.
Термином «разветвление» обозначают входящую в такие р-ции стадию размножения
активных частиц.
Осн. понятие теории разветвленных цепных реакций-
фактор разветвления цепи f, противоположный фактору гибели
g
переносчиков цепи в р-циях обрыва. Ур-ние (1) с учетом разветвления
цепи записывается в виде:
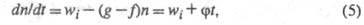
где
До тех пор пока g > f, будет наблюдаться цепная реакция, кинетика
к-рой не отличается от неразветвленных цепных реакций. С ростом f в соответствии
с (2) п будет нарастать до все более высоких стационарных значений:
п = wi /(g
-f).
Если же f станет больше
g, т.
е.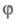
положит. величиной, решением ур-ния (5) будет выражение:
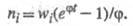
Выражение для скорости цепных реакций, известное
как ур-ние Семенова, имеет вид:
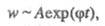
т. е. концентрация активных частиц не принимает
стационарного значения, а непрерывно нарастает, как и пропорциональная
ей скорость цепной реакции, переходящей в самовоспламенение. Условие g = f ,
или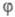
— граничное для перехода от стационарного режима разветвленно-цепного процесса
к нестационарному, протекающему с самоускорением (рис. 1). Чем быстрее
р-ция, чем больше концентрация активных частиц, тем сильнее ускоряется
р-ция. Т. обр., для разветвленных цепных реакций реализуется положит. oбратная связь.
Рис. 1. Динамика разветвленного
цепного процесса при различных соотношениях факторов обрыва и разветвления
цепи (соотв. g и f,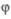
—
g); w — скорость цепной р-ции, t — время.
Переход от стационарного к нестационарному
протеканию цепной реакции может происходить как при увеличении
f, так и при
уменьшении g. Очевидно, что чем ближе условия к граничному f
= g, тем меньшие изменения f или g
могут привести
к срыву и переходу р-ции в режим самоускорения.
Наиб. детально изучено разветвление-цепное
окисление Н2 в смеси с О2. Р-ция инициирования
продолжение цепи определяется р-циями:
Суммарная р-ция:
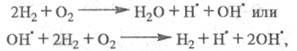
т. е. в ЦПЦ не только образуется продукт
Н2О и регенерируются переносчики цепи
но и возникают еще два переносчика цепи
и
из переносчиков цепи может либо погибнуть в р-циях обрыва, либо начать
новое звено цепи, с образованием еще большего числа переносчиков цепи.
Приведенная ниже схема развития цепного процесса в условиях, когда f
>
g, наглядно иллюстрирует явление разветвления цепи:
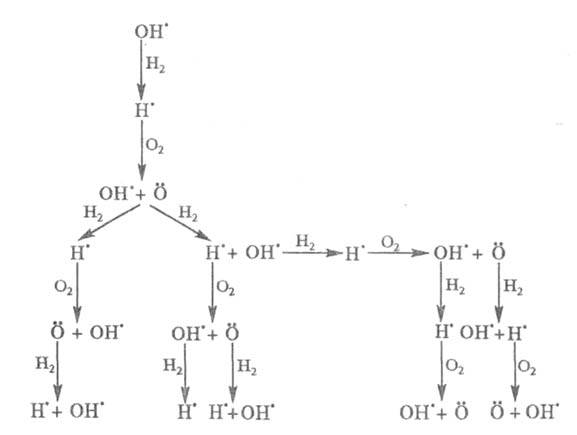
Все известные разветвленно-цепные р-ции
являются экзотермическими, причем часть выделяемой энергии переходит в
энергию активных частиц. Поэтому для разветвления цепи необходимо, чтобы
тепловой эффект брутто-процесса значительно превосходил тепловой эффект
наиб. энергоемкой из всех стадий разветвления (для окисления Н2
это соотв. 483 и 70 кДж/моль).
К изученным разветвленно-цепным р-циям
относятся окисление паров Р, S; р-ции О2 с CS2, CO,
SiH4, углеводородами; разложение NC13. Для всех этих
р-ций характерно наличие нижнего и верхнего пределов самовоспламенения.
Их происхождение определяется переходами через граничное условие f =
g.
В случае газофазных р-ций при низком давлении р диффузия переносчиков
цепи к стенке и их гибель обусловливает неравенство g >
f и
р-ция практически не наблюдается. Рост давления препятствует диффузии,
при этом g уменьшается, а f растет, т. к. обычно в р-ции
разветвления участвует один из реагентов, давление к-рого составляет часть
общего давления. При переходе через граничное условие f =
g происходит
самоускорение р-ции и самовоспламенение смеси. Граничному условию соответствует
нек-рое значение р1 -давление нижнего предела
самовоспламенения. Соотношение f > g соблюдается при р>р1,
но при дальнейшем росте р способность смеси к самовоспламенению
исчезает. С ростом р растет доля тримолекулярных соударений, в результате
к-рых происходит гибель переносчиков цепи в газовой фазе. Это м. б. также
столкновения двух активных частиц с любой третьей частицей М и переход
активной частицы в малоактивную, не участвующую в р-циях продолжения и
разветвления цепи. Так, в смеси Н2 с О2 возможна
гибель
р-ции
с послед. гибелью
в р-циях друг с другом или с переносчиками цепи
и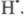
счет тримолекулярных р-ций фактор g, пропорциональный р2,
опережает в своем росте фактор f, пропорциональный р. В результате
при нек-ром р2 — давлении верхнего предела -вновь происходит
переход через граничное условие f = g и смесь теряет способность
к самовоспламенению. Явление верхнего предела было открыто и объяснено
С. Хиншелвудом (1956). Семенову и Хиншелвуду за исследование механизма
хим. р-ций была присуждена Нобелевская премия.
С ростом т-ры Т область воспламенения
— разность между р2 и р1
— расширяется, т. к. фактор f, характеризующий энергоемкую р-цию
разветвления, возрастает с ростом Т значительно, а фактор g от
Т
зависит слабо. В случае понижения Т и р2при
нек-рой Т значения pl и р2становятся
одинаковыми. Зависимости pl и р2
от T образуют характерный полуостров воспламенения (рис. 2). Контур
этого полуострова может изменяться при изменении условий опыта. Так, при
увеличении отношения S/V, напр. введением в сосуд стержней, g
возрастает
и происходит повышение нижнего предела р1как ф-ции Т.
Тот же эффект проявляется при уменьшении диаметра сосуда, т. е. увеличении
S/V. Разбавление смеси инертным газом затрудняет диффузию активных
частиц к стенке и одновременно повышает долю тримолекулярных столкновений
из-за роста общего давления. В результате происходят уменьшение g в
области нижнего предела самовоспламенения и рост g в области верхнего
предела. При введении ингибитора контур полуострова воспламенения изменяется,
нижний предел повышается, верхний — понижается.
Рис. 2. Полуостров воспламенения
смеси водорода с кислородом.
Самоускорение цепных реакций с разветвлением цепей,
описываемое ур-нием Семенова, обусловлено переходом энергии экзотермич.
р-ции в хим. энергию активных частиц. Так, в определенных условиях до половины
кол-ва молекул Н2 в режиме самовоспламенения может существовать
в форме атомов
Другая возможность — переход энергии экзотермич. хим. р-ции в кинетич.
энергию частиц и рост т-ры в случае, если скорость разогревания смеси превышает
скорость отвода тепла от сосуда. Повышение т-ры приводит к ускорению р-ции,
повышению интенсивности тепловыделения и дальнейшему росту т-ры и скорости
р-ции — тепловому взрыву. В основе такого процесса м. б. как неразветвленная
цепная реакция, так и р-ция с разветвлением цепей. В последнем случае появляется
т. наз. третий предел самовоспламенения: смесь, потерявшая способность
к самовоспламенению при р>р2, с послед. повышением
р
вновь становится самовоспламеняющейся.
Энергетическое разветвление цепей. Возможен
переход энергии хим. р-ции в энергию возбуждения внутр. степеней свободы
частиц, образующихся в экзотермич. элементарной стадии; в этом случае нарушается
равновесное распределение частиц по энергиям. Сверхравновесная концентрация
вращательно-возбужденных состояний быстро, в результате неск. соударений,
уменьшается до равновесной. Для диссипации избыточной колебат. энергии
необходимо участие возбужденной частицы в тысячах соударений, т. е. время
жизни колебательно-возбужденных состояний много больше, чем вращательно-возбужденных.
Это может привести к росту скорости р-ции, т. к. константы скорости с участием
колебательно-возбужденных частиц м. б. на много порядков больше, чем для
невозбужденных.
Впервые роль колебательно-возбужденных
состояний в самоускорении разветвленно-цепных р-ций была выявлена для высокоэкзотермич.
р-ции
Н2 + F2
2HF;
-537 кДж/моль
Аналогичная р-ция Н2 + С12
протекает как неразветвленный процесс. В отсутствие светового воздействия
для обеих р-ций инициирование происходит на стенке сосуда: (Х2
+ S
SX +
и в объеме (Х2 + М
М + 2Х), где X — С1 или F. Большая разница энергий связи F — F (159 кДж/моль)
и Н — F (565 кДж/моль) определяет еще один канал образования атомарного
F:

Для аналогичной р-ции с участием С12
необходимо затратить 248 кДж/моль, т. е. такая р-ция практически не происходит.
Р-ции продолжения цепи для обеих систем подобны:
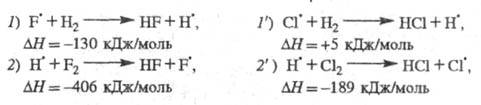
Энергия, выделяющаяся в р-циях 7,2 и 2′,
частично переходит в энергию колебат. возбуждения продуктов — соотв. HF
и НС1. При последующих соударениях избыточная колебат. энергия рассеивается
— переходит в поступат. и вращат. энергию мн. других частиц.
Имеются, однако, две возможности перехода
колебат. энергии в хим. энергию активных частиц. Если энергия возбуждения
конечного или промежут. продукта достаточна для его распада на активные
частицы, может пойти р-ция размножения частиц. В рассматриваемых р-циях
такая возможность отсутствует, т. к. соответствующие энергии связи составляют
565 (для Н — F) и 431 кДж/моль (для Н — С1), т. е. они больше, чем тепловые
эффекты р-ций соотв. 2 и 2′.
Вторая возможность — передача энергии
колебат. возбуждения продукта на частицу реагента. Такая передача тем вероятней,
чем ближе значения энергий колебат. возбуждения сталкивающихся частиц.
Для рассматриваемых частиц колебат. кванты таковы (в кДж/моль):
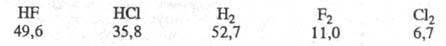
Энергии колебат. возбуждения близки лишь
для пары HF-H2. Между этими частицами может протекать реакция
(значок v означает колебат. возбуждение). Частица
как и Н2, реагирует с F2, но для р-ции
тепловой эффект составляет не +30, а -22,7 кДж/моль, а ее константа скорости
примерно в 107 больше, чем для р-ции невозбужденного Н2.
Дополнив р-ции 7 и 2 рассмотренными р-циями колебательно-возбужденных частиц,
получаем след. ЦПЦ:
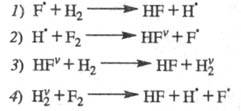
Сумарная р-ция:
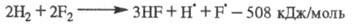
Все особенности разветвленно-цепных р-ций
— существование нижнего и верхнего предельных давлений, наличие полуострова
воспламенения, зависимость положения нижнего предела от размеров сосуда
и т. п.- присущи и этой р-ции с энергетич. разветвлением цепи.
Энергетич. разветвление цепей было открыто
в 1963 Семеновым. Впоследствии было обнаружено энергетич. разветвление
цепей без передачи энергии колебат. возбуждения. Так, для р-ции CH2F2
+ 2F2
CF4 + 2HF был установлен механизм разветвления цепей в результате
распада промежут. в-ва, образующегося в состоянии колебат. возбуждения:
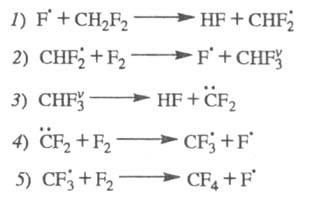
Суммарная р-ция:

По механизму цепных реакций с энергетич. разветвлением
происходят газофазное фторирование СН4 и его галогенпроизводных,
фторирование этана, окисление тетрафторэтилена и ряда хлорзамещенных олефинов,
хлорирование силана и нек-рые др. процессы. Поскольку в цепных реакций с энергетич.
разветвлением возникает инверсная заселенность колебат. уровней, такие
цепные реакции представляют практич. интерес для решения проблемы создания лазеров
с хим. накачкой (см. Лазеры химические).
Разветвленно-цепные р-ции могут протекать
стационарно, если g > f, и с самоускорением, если f >
g. Значения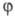
— g таковы, что вся р-ция протекает за доли секунды.
Р-ции с вырожденным разветвлением.
Такое
назв. получили многочисленные радикально-цепные р-ции, для к-рых характерно
самоускорение, описываемое ур-нием Семенова с очень малыми значениями
Для таких р-ций обычно не наблюдается перехода в режим самовоспламенения
или взрыва. По достижении нек-рой макс. скорости такие р-ции замедляются
(рис. 3). С этим связано второе назв. таких р-ций — вырожденный цепной
взрыв. Характерное время их ускоренного протекания — не доли секунды, а
десятки минут и часов. Различие величин j
определяет различие механизмов.
Рис. 3. Динамика процессов с вырожденным
разветвлением цепей (1) и разветвленного цепного (2). Заштрихованные площади
отражают кол-во реагентов, прореагировавших к моменту времени t.
Рассмотрим, напр., цепное окисление углеводородов.
В этом случае ЦПЦ включает след. р-ции:
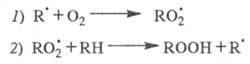
В отсутствие инициатора инициирование происходит
по р-ции:
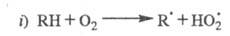
Радикалы
не участвуют в ЦПЦ и исчезают в разл. р-циях гибели на стенке и в объеме.
Концентрации частиц
и
доли секунды достигают своего стационарного значения, определяемого ур-нием
(2), a ROOH накапливается в системе и служит инициатором:

Последующее быстрое образование переносчика
цепи
происходит в результате р-ций:
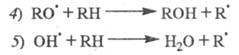
Т. обр., по мере протекания р-ции и накопления
ROOH скорость инициирования растет:
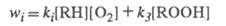
Чем больше wi, тем больше
скорость образования ROOH, a чем больше [ROOH], тем сильнее ускоряется
инициирование. Так реализуется положит. обратная связь в случае р-ций с
вырожденным разветвлением цепей. Суммарная р-ция:
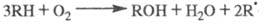
Это ур-ние ничем не отличается от аналогичного
для разветвленно-цепных р-ций, и если бы распад ROOH на
и
с характерным временем, соизмеримым со временем развития звена цепи, не
было бы отличия в их поведении. В действительности же эти времена сильно
разнятся. Одна р-ция разветвления 3 приходится на многие тысячи
р-ций 1 и 2, составляющих ЦПЦ неразветвленного окисления
RH. Рост [ROOH] в ходе р-ции мог бы тем не менее привести к тому, что величины
k3[ROOH] и
стали бы соизмеримы. Этого не происходит из-за того, что ROOH — нестабильный
промежут. продукт, и со скоростью, намного большей, чем для р-ции 5, происходит
превращение ROOH в стабильные продукты окисления RH — кетоны, к-ты и др.
по р-ции:

Поскольку
не происходит значит, накапливания ROOH, а по мере его накапливания расход
RH по р-циям 1, 2 и 6 оказывается столь большим, что скорость всех
р-ций с участием RH падает значительно. Рассмотренными факторами и определяются
характерные особенности вырожденно-разветвленных цепных реакций: рост скорости на
начальных стадиях, описываемый ур-нием
но с очень малым
уменьшение скорости р-ции на более поздних стадиях р-ции. К р-циям с вырожденным
разветвлением относятся многочисленные р-ции окисления не только углеводородов,
но и большинства др. орг. соединений, поскольку их общим св-вом является
промежут. образование ROOH. Подобным образом протекает и окисление сероводорода.
Большой вклад в изучение этих р-ций был
сделан А. Б. Налбандяном и Н. М. Эмануэлем. Большое значение имело открытие
разветвленных и вырожденно-разветвленных цепных реакций для создания теории горения.
Р-ции с вырожденным разветвлением цепей
при повышенных т-рах могут протекать как разветвленно-цепные. Так, H2S
реагирует с О2 при 250-300 °С по механизму вырожденного разветвления
цепей, а при 350-400 °С наблюдаются нижний и верхний пределы самовоспламенения.
По-видимому, при повышенных т-рах становятся существенными р-ции разветвления,
к-рые не идут при низких т-рах. Для окисления углеводородов Семенов рассмотрел
возможность разветвления в результате высокотемпературного распада
на
и альдегид R»CHO и последующей р-ции
Образование ответственного за разветвление
промежут. продукта в результате протекания неразветвленно-цепной р-ции
и возможность перехода р-ций с вырожденным разветвлением в разветвленно-цепные
свидетельствует о том, что механизм вырожденного разветвления цепей занимает
промежут. положение между неразветвленным и разветвленно-цепным механизмами.
Лит.: Семёнов Н. Н., Развитие теории
цепных реакций и теплового воспламенения, М., 1969; Проблемы химической
кинетики, М., 1979; Налбандян А. Б., Варданян И. А., Современное состояние
проблемы газофазного окисления органических соединений, Ер., 1986.
А. П. Пурмаль.
Оглавление
Основные
понятия и стадии цепных реакций.
Неразветвлённые
цепные реакции.
Теория
обрыва цепей разработана Н.Н. Семёновым.
Разветвлённые
цепные реакции.
Основные понятия и стадии цепных реакций.
Цепные реакции – это сложные
превращения реагентов в продукты. Особенностью цепных реакций является их цикличность.
Эта цикличность обусловлена регулярным чередованием реакций с участием активных
центров. Этими активными центрами могут быть атомы и свободные радикалы с высокой
реакционной способностью, а также ионы и возбуждённые молекулы.
Различают реакции с энергетическими и
материальными цепями в зависимости от природы активных центров. В первом случае
происходит возбуждение молекулы без разрыва связей. Во втором – гомолитический
распад молекулы с образованием частиц с неспаренными электронами.
Примеров цепных реакций можно
привести множество: взаимодействие водорода и углеводородов с хлором и бромом,
термическое разложение озона, крекинг углеводородов, реакции полимеризации и
поликонденсации, ядерные реакции.
Любая цепная реакция трёхстадийна. На
первой стадии образуются исходные активные центры, т.е. происходит зарождение
цепи. Эти активные центры взаимодействуют со стабильными молекулами с
образованием одной или нескольких активных частиц. Эта стадия имеет название
стадии развития или продолжения цепи. Наконец, две активные частицы могут
рекомбинировать в стабильную молекулу, в результате чего цепь обрывается,
поэтому эта стадия – стадия обрыва цепи.
Первая стадия – наиболее энергоёмкая и, как правило, инициируется квантом света,
участием фотосенсибилизатора, либо неустойчивыми соединениями типа пероксидов и
азосоединений, а также парами легколетучих металлов (натрий, ртуть и др.) и
многими неорганическими соединениями.
Стадия развития цепи может включать в себя реакции продолжения и развития цепи.
Энергии активации этих элементарных стадий невелики, поэтому они протекают со
значительными скоростями. К этим реакциям относятся:
1. Взаимодействие атома или свободного
радикала с молекулой реагента с образованием новых свободных радикалов;
2. Взаимодействие атома или свободного
радикала с молекулой реагента с образованием нового радикала и продукта
реакции;
3. Мономолекулярная изомеризация
радикала;
4. Мономолекулярный распад свободного радикала
с образованием нового радикала и продукта;
5. Взаимодействие свободных радикалов с
образованием нового радикала и продукта.
Если на стадии развития цепи протекают реакции, в результате
которых число активных центров вырастает, то говорят о разветвлении цепей.
И, наконец, стадии
обрыва цепи, это элементарные стадии, приводящие к исчезновению
свободной валентности. Обрыв цепи может быть гомогенным (с участием инертной
частицы) или гетерогенным (взаимодействие радикалов со стенкой реактора).
Следует иметь в виду, что рекомбинация радикалов в объёме без участия третьей
частицы невозможна, т.к. образованная молекула будет находиться в возбуждённом
состоянии и требуется «отбор» лишней энергии для стабилизации молекулы,
полученной рекомбинацией радикалов.
Процессы обрыва цепи в объёме протекают при больших
давлениях, и скорость обрыва будет иметь второй порядок по концентрациям
активных центров. В этом случае обрыв цепи называют квадратичным.
В общем случае любую цепную реакцию можно представить в виде
следующей схемы:
реагент +
αХ → продукт + βY
Х и Y – активные центры.
α и
β – целые числа большие или равные 0.
Исходя из этой схемы, стадии можно представить следующим
образом:
α=0, β≠0 – зарождение цепи.
α=β – продолжение цепи.
α<β – разветвление цепи.
α≠0, β=0 – обрыв цепи.
Неразветвлённые цепные реакции.
Неразветвлённые цепные реакции – это
реакции, включающие в себя стадии зарождения, продолжения и обрыва цепи.
Теория этих реакций разработана
школой Боденштейна. Типичным, классическим примером этого типа реакций является
синтез HCl из H2 и Сl2 при действии света.
Неразветвлённые цепные реакции
характеризуются понятиями звено и длина цепи. Началом звена цепи считается
реакция продолжения с участием радикала, который образуется в стадии зарождения
цепи. Звено цепи — это совокупность
последовательных стадий реакций продолжения цепи с регенерацией активного
центра, уже участвовавшего в реакции.
Например, в радикальной реакции
хлорирования алкана:
звено цепи включает 2 элементарные реакции:
Сумма этих элементарных реакций
приводит к молекулярной реакции. Число полных звеньев, приходящихся в среднем
на каждый активный центр, образовавшийся в реакции зарождения цепи – средняя
длина цепи. Так, в приведённой реакции:
В феноменологической (формальной)
кинетике цепных реакций возможны два подхода. Первый основан на решении
дифференциальных и алгебраических уравнений, полученных на основе закона
действующих масс и механизма данной цепной реакции. Для неразветвлённых цепных
реакций применим метод стационарных концентраций Боденштейна. Второй подход
основан на вероятностном характере химических процессов вообще и цепных реакций
в частности.
Любая активная частица,
образовавшаяся в результате акта зарождения цепи, входит в цикл реакций
продолжения цепи – звено цепи. При этом она реализует превращение молекул
реагента в молекулы продукта и выходит из этого цикла в виде частицы,
неотличимой от вошедшей в него. Далее она либо участвует в следующем звене,
либо выходит из цикла путём рекомбинации. Вероятность рекомбинации одинакова на
любом его звене, т.е. она постоянна. Таким образом, процессы обрыва цепи – это
процессы стохастические и могут быть охарактеризованы постоянным параметром – вероятностью
обрыва цепи β. Но поскольку на каждой стадии происходит либо обрыв
цепи, либо продолжение, то очевидно, что вероятность продолжения цепи
α=1-β.
Исходя из этого, средняя длина цепи
может быть вычислена:
где rr – скорость роста цепи.
rf – скорость обрывацепи.
Очевидно, при β<<1,
т.е. при большой длине цепи:
Для цепных реакций ν сильно
зависит от концентрации и чистоты реагентов, интенсивности света, температуры,
материала ректора и его размеров.
Условием стационарности в
неразветвлённых цепных реакциях является равенство скоростей инициирования и
обрыва цепей:
r0=rf
Скорость реакции будет выражаться:
Для скорости изменения концентрации
активных центров можно записать уравнение (при линейном обрыве цепи, т.е. при
низких давлениях):
где g – удельная скорость обрыва цепи.
При n=0, t=0 и r0=const,
g=const получаем:
Зависимость скорости реакции от
времени примет вид:
где l – удельная скорость реакции продолжения
цепи.
Из последнего уравнения видно, что
при
, т.е.
устанавливается стационарный режим.
Теория обрыва цепей разработана Н.Н. Семёновым.
Различают диффузионную и кинетическую
области реакции обрыва цепи. В кинетической области скорость обрыва
определяется скоростью адсорбции частиц на стенке. Эта скорость пропорциональна
и зависит от
— вероятности
захвата стенкой свободных радикалов ().
Константа скорости обрыва цепи для цилиндрического сосуда рассчитывается по уравнению:
где D – коэффициент диффузии,
d – диаметр реактора,
— средняя скорость (арифметическая).
Если обрыв цепи обусловлен диффузией,
то
В кинетической области:
Разветвлённые цепные реакции.
Цепные реакции, включающие стадии
зарождения, разветвления и обрыва цепи называются разветвлёнными. Это процессы
окисления белого фосфора и фосфина, водорода и оксида углерода (IV).
Теория этих реакций разработана Н.Н.
Семёновым и Хиншелвудом. Было показано, что при описании развития этих реакций
система кинетических уравнений для активных центров может быть сведена к
уравнению для активных центров одного вида.
В дифференциальном уравнении
появляется член, учитывающий скорость образования активных центров.
где
После
интегрирования получаем:
где
gn – скорость
гибели активных центров.
fn – скорость образования активных
центров.
По аналогии с неразветвлёнными
цепными реакциями можно получить выражение для скорости:
где l – удельная скорость реакции
продолжения цепи.
Анализ этих уравнений показывает:
1.
а) t=0
т.е.
в начальный момент n и r линейно
зависят от t.
б)


т.е. с
течением времени устанавливается стационарный режим.
2. т.е.

т.е. по истечению некоторого времени, если скорость
образования активных центров превышает скорость их гибели, скорость процесса
экспоненциально возрастает и по завершению периода индукции заканчивается
взрывом даже при постоянной температуре. В этом случае воспламенение
обусловлено спонтанным ростом скорости реакции из-за быстрого размножения
активных центров.
3. f=g
Тогда выражение для скорости после раскрытия
неопределённости по правилу Лопиталя примет вид:
т.е. реакция протекает без воспламенения, часто с
чрезвычайно малой скоростью.
Дифференциальное уравнение
для конкретных реакций можно получить, как было
показано Н.Н, Семёновым, методом частично стационарных концентраций. Метод
стационарных концентраций для цепных реакций неприменим, поскольку концентрация
одного из активных центров существенно возрастает в ходе процесса. Так, при
окислении водорода в соответствии с общепринятым механизмом можно считать:


т.е. при определении скорости убыли атомарного
водорода необходимо решить полное дифференциальное уравнение.
Анализ кинетических уравнений
позволяет объяснить удивительные явления при окислении фосфора и водорода. Было
обнаружено экспериментально, что при окислении воспламенение наблюдается только
при определённых давлениях. Это можно показать графически.
В области с координатами точки А реакционная смесь не
воспламеняется. Чтобы смесь воспламенилась, можно не только увеличить
температуру до Т1, но и уменьшить давление до р1, т.е.
для этих реакций наблюдается явление увеличения скорости реакции при уменьшении
числа частиц в единице объёма, что противоречит закону действующих масс.
Эта закономерность объясняется
следующим образом. При малых давлениях увеличивается длина свободного частиц и
увеличивается вероятность обрыва цепи на стенках реактора, т.е. реакция
переходит в стационарный режим:
при

При давлениях в области воспламенения
разветвление преобладает над обрывом, т.е.
и скорость процесса становится
экспоненциальной. При дальнейшем увеличении давления возрастает вероятность
квадратичного обрыва цепей, и система вновь переходит на стационарный режим.
Примером разветвлённой цепной реакции
является реакция деления урана:
В результате реакции выделяется энергия и в форме
теплоты передаётся в окружающую среду, но в каждом акте деления урана
образуется в среднем 2,5 нейтрона, которые «размножаются» в геометрической
прогрессии и приводят к лавинообразному возрастанию числа делящихся атомов и к
взрыву.
Отметим следующий факт. Мы
рассмотрели пример, когда пределы воспламенения смеси Н2 + О2
не зависят от r0. Этот
результат связан с тем, что реакции разветвления и обрыва цепей рассматриваются
как линейные относительно концентрации активных центров, а квадратичные
процессы не учитываются.
Однако эксперимент показывает, что
увеличение скорости зарождения цепей приводит к значительному расширению
области воспламенения гремучей смеси и к ускорению разветвления. В этом случае
считают, что наблюдается положительное взаимодействие цепей.
Для скорости изменения концентраций с
положительным взаимодействием цепей дифференциальное уравнение имеет вид:
где cn2 – скорость квадратичного разветвления цепей.
Принципиально от разветвлённых цепных
реакций отличаются реакции с вырожденным разветвлением. Для них не наблюдается
перехода в режим самовоспламенения и взрыва.
Рассмотрим окисление углеводородов.
При низкотемпературном окислении на одной из стадий продолжения цепи образуется
гидропероксид:
может
стать источником свободных радикалов:
что приводит к возникновению новых цепей.
Когда степень превращения реагентов
невелика и можно пренебречь убылью промежуточных продуктов, то кинетику этих
реакций можно описать системой:
р – концентрация промежуточного продукта.
l – удельная скорость продолжения
цепи.
Если (<<), то
Второе уравнение после интегрирования с граничным
условием
при
даёт следующее выражение:
Если рассматривать квадратичный обрыв
цепей, то система дифференциальных уравнений имеет вид:
В этом случае автоускорение выражено менее резко, чем для
линейного обрыва цепей.