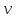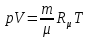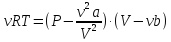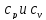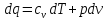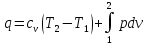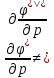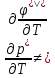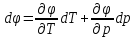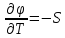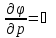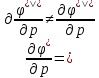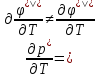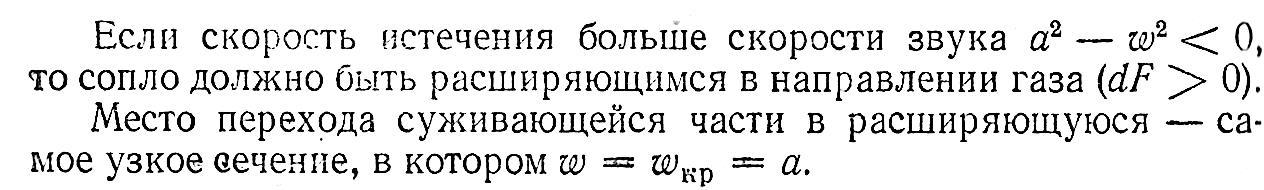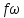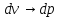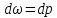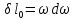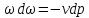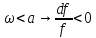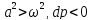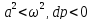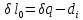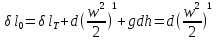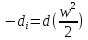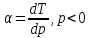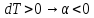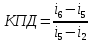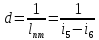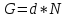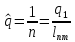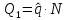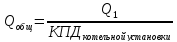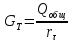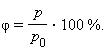Ответы
на вопросы по термодинамике.
-
Термодинамическая
система. Взаимодействие системы с
окружающей средой. Открытая, закрытая,
изолированная, термодеформационная
системы.
Термодинамическая
система-
тело, совокупность тел, часть тела
подлежащее исследованию. Все остальные
тела называются окружающей средой.
Взаимодействие
системы с окружающей средой заключается
в обмене веществом и энергией.
Система,
которая может обмениваться с окружающей
средой энергии и веществом называется
открытой.
Система, которая не может обмениваться
веществом называется закрытой.
Система,
которая не может обмениваться не
энергией, не веществом – изолированная.
Система,
в которой теплообмен представлен в виде
Q
и Aмех,
связанной с упругой деформацией
растяжения/сжатия, называется
термодеформационной.
-
Экстенсивные
и интенсивные параметры состояния.
Уравнения состояния для идеального и
реального газов (уравнение Клапейрона-
Менделеева и уравнение Ван-дер-Ваальса).
Начну
с того, что любое энергетическое влияние
характеризуется двумя параметрами:
-
интенсивные-
параметры, которые не зависят от
количества вещества, а следовательно
и от массы системы. Например, температура,
давление. все удельные величины. -
Экстенсивные-
параметры, зависящие от количества
вещества, в следствии чего и от массы
системы. Например, объем системы, ее
масса.
Клапейрона-
Менделеева
– удельный
объем,
-универсальная газовая постоянная.
Уравнение
Ван-дер-Ваальса
-
Зависимость
количества передаваемой теплоты, работы
закрытой и открытой систем от параметров
состояния. Изображение работы и теплоты
в p-v
и T-s
диаграммах. -
Понятие
истинной и средней теплоемкостей.
Уравнение Майнера. Расчет теплоемкостей
идеального газа. Зависимость теплоемкости
от показателя политропы (формула и
график) -
Внутренняя
энергия, энтальпия. Физический смысл.
Расчет изменение внутренней энергии
и энтальпии идеального газа. -
Первый
закон термодинамики (первое и второе
уравнения). Физический смысл, различные
формы записи.
Если
отталкиваться от лекций, то первый
закон ТД
заключается в том, что процессы в
термодинамической системе могут
возникать тогда и только тогда, когда
на систему оказывается внешнее
энергетическое воздействие. А полученное
тепло системой идет на совершение работы
и увеличение внутренней энергии.
в
учебнике по теории смысл такой же, а вот
формулы другие:
В
интегральной форме:
-
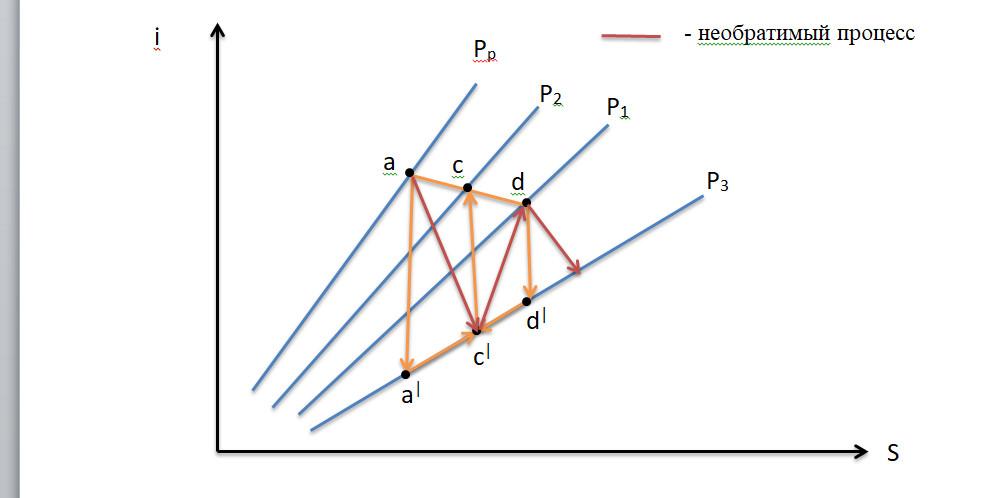
Термодинамический
процесс. Равновесность. Обратимость.
Политропный процесс. Вывод уравнения
политропного процесса. -
Расчет
термодинамических величин (работы
закрытой и открытой системы, количества
теплоты, изменение внутренней энергии
и энтальпии). -
Расчет
энтропии и ее изменения в политропном
процессе. -
Частные
процессы идеального газа. Изображение
на диаграммах состояния. -
Частные
процессы идеального газа. Расчет
термодинамических величин (работы
закрытой и открытой системы, количества
теплоты , изменения внутренней энергии
и энтальпии) -
Анализ
политропного процесса по диаграммам
состояния. -
Определение
показателя политропы. Расчет произвольного
процесса идеального газа. -
Прямые
и обратные циклы. Определение эффективности
циклов (коэффициент полезного действия,
холодильный коэффициент, отопительный
коэффициент). Циклы как метод
термодинамического аналог. -
Прямой
цикл Карно. Основные выводы, получаемые
при анализе цикла Карно. -
Второй
закон термодинамики. Физический смысл,
математическое выражение. Примеры
(неравновесный теплообмен). Статический
смысл. -
Характеристические
функции. Аналитические выражения,
области применения. -
Эксергия.
Физический смысл. Вывод уравнения для
расчета эксергии и ее изменения в
термодинамическом процессе. -
Реальный
газ. Фазовые превращения первого и
второго рода.
Реальный
газ
Отличия
реального газа от идеального, заключаются
в наличии сил взаимодействия между
молекулами и в учёте собственного объема
молекул,
которые
для идеальных газов не учитывались. Это
выражается, прежде всего, в наличии
потенциальной части внутренней энергии,
в изменении уравнения
состояния,
в зависимости теплоёмкости от температуры
и давления и в
переходе
реальных газов при определённых
термодинамических параметрах в жидкое
и твёрдое состояние.
Фазовые
превращения первого и второго рода.
Фаза
– гомогенная однородная область в
гетерогенной среде на границе которой
имеет некоторые свойства вещества
претерпевают скачкообразное изменение.
Фазовые
превращения первого рода
Их
можно охарактеризовать неравенством
первой производной энергии Гиббса:
Так
же эти переходы характеризуются
Характеризуются
поглощением или выделением Q.
Фазовые
переходы второго рода
Такие
переходы тоже можно охарактеризовать
производными энергии Гиббса.
20.
Реальный газ. Диаграммы состояния p-T,
p-v,
T-s,
i-s.
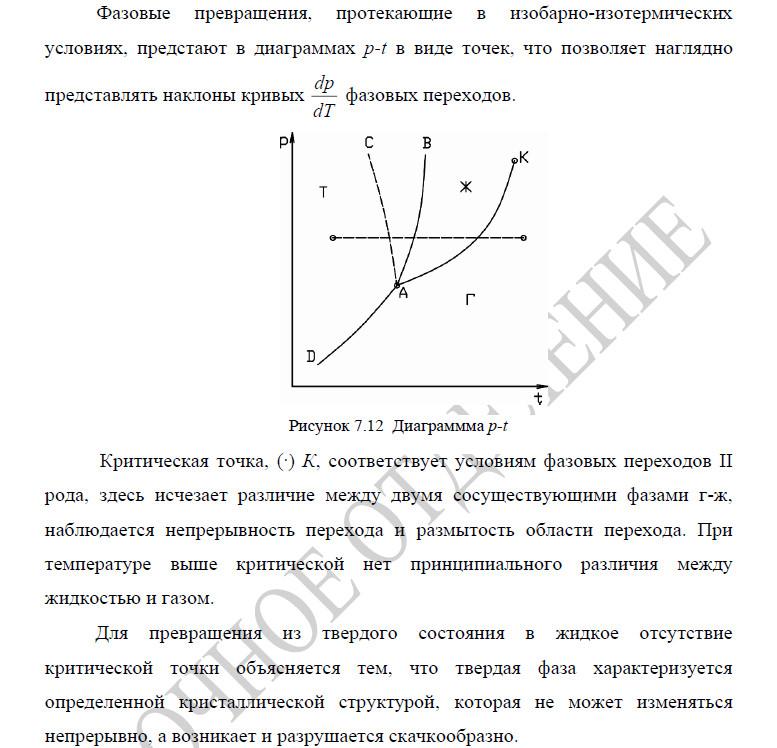
Критическая точка. Тройная точка.
Пограничные кривые. Изображение частных
процессов на диаграммах состояния.
Реальный
газ
Отличия
реального газа от идеального, заключаются
в наличии сил взаимодействия между
молекулами и в учёте собственного объема
молекул,
которые
для идеальных газов не учитывались. Это
выражается, прежде всего, в наличии
потенциальной части внутренней энергии,
в изменении уравнения
состояния,
в зависимости теплоёмкости от температуры
и давления и в
переходе
реальных газов при определённых
термодинамических параметрах в жидкое
и твёрдое состояние.
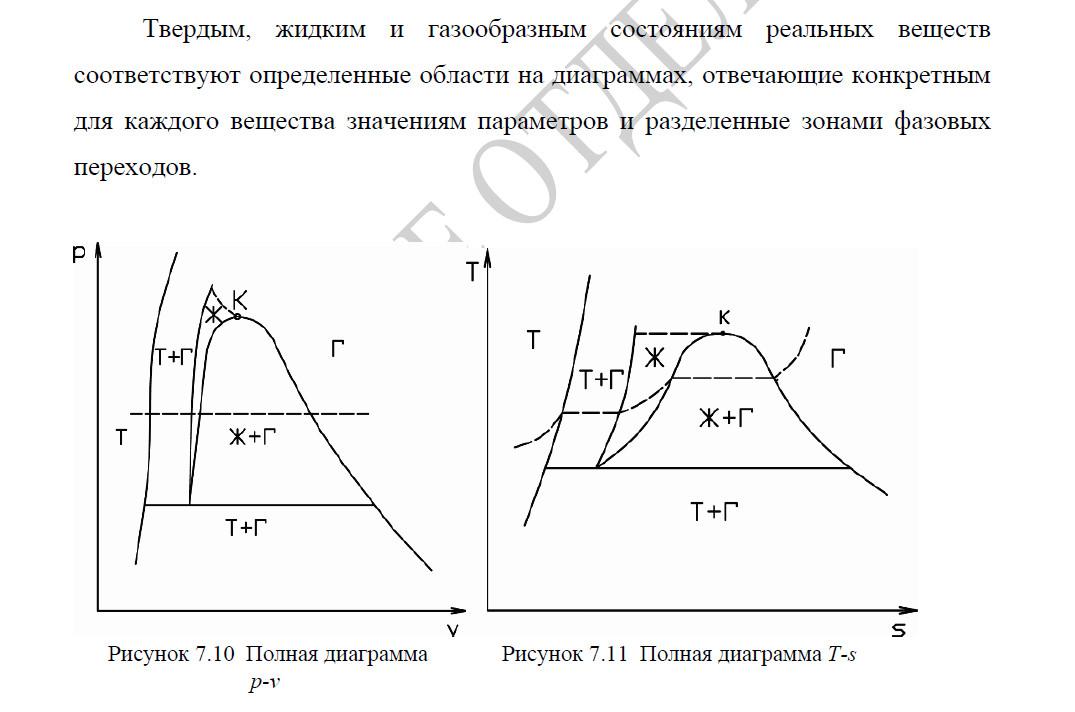
Критическая
точка
Диаграммы
21.
Определение параметров состояния
реального газа на пограничных кривых.
Определения параметров состояния
влажного и перегретого паров.
22.
Вывод уравнений для расчёта теплоты
парообразования. Зависимость теплоты
парообразования от температуры и
давления. Изображение в T-s
координатах.
23.
Уравнение Клаперона- Клаузиуса. Вывод
уравнения, физический смысл. Интегральные
формы уравнения. Связь уравнения с
диаграммой состояния р-Т.
24.
Реальные газы. Расчет частных процессов
и их изображение на диаграммах состояния
p-v
, T-s,
i-s.
25.
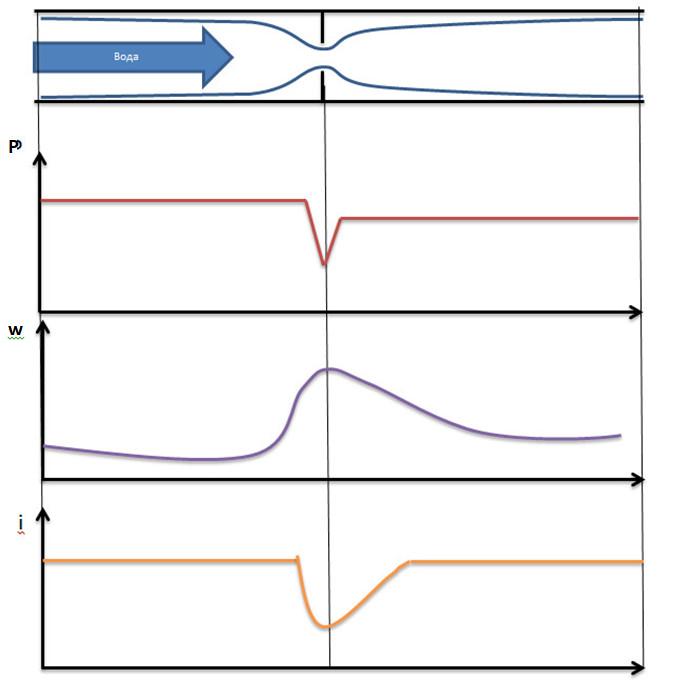
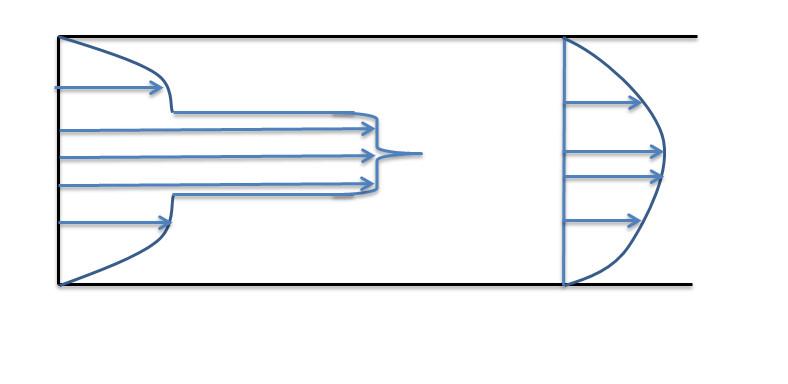
Течение газов через конфузор. Предельная
скорость течения. Учет трения.
26.
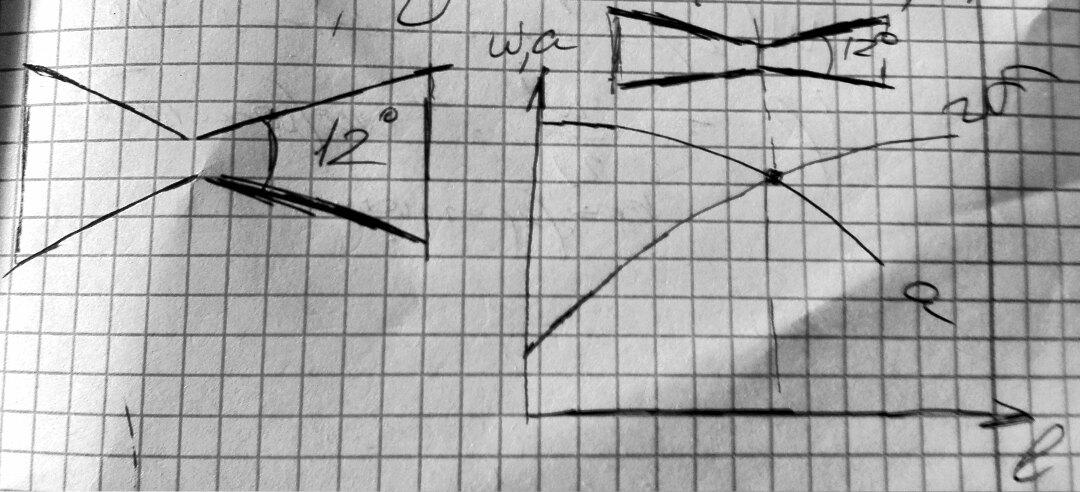
Получение сверхзвуковых скоростей.
Сопло Левеля.
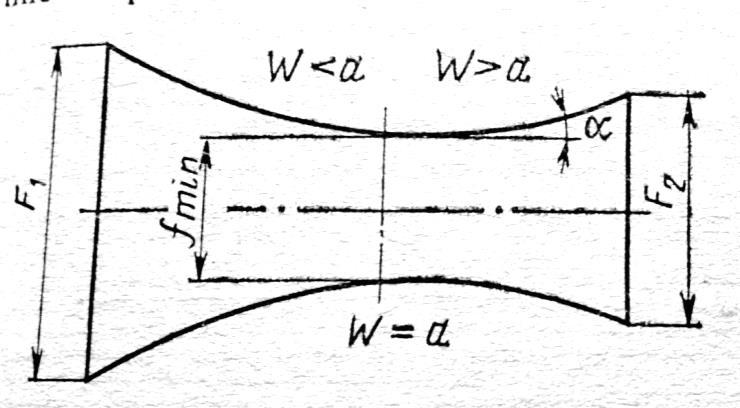
Скорость
газа большую скорости звука можно
получить в комбинированном сопле,
состоящем из суживающейся расширяющейся
части. Это сопло имеет название
Лаваля.(Левеля (честно все равно)).
Сужающая
часть работает при до звуковой скорости
(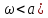
расширяющаяся – при сверхзвуковой (
В меньшем сечении сопла скорость потока
равна местной скорости звука.
Это
показывает уравнение (смотрите
я делаю два варианта, выберите сами)
:
Вариант
1
Вариант
2

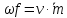
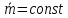

на
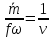
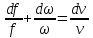
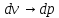

1.

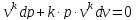

(2)
2.
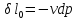
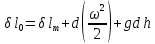
где
,
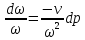
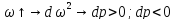
Соединим
все уравнения:
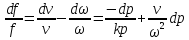
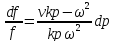
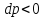
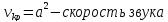
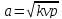
1.
Если увеличивающаяся скорость потока
меньше скорость звука, то
2.
27.
Дросселированние. Дроссель эффект.
Дросселирование
– понижение давления потока при
прохождении через резкое сужение.
Температурный
эффект Джоуля Томпсона.
1)
2)
3)
Геометрические
места точек, где дроссель эффект равен
0, называется кривой инверсии.
Для
идеального газа дроссель эффект равен
=0
Это
из методы.
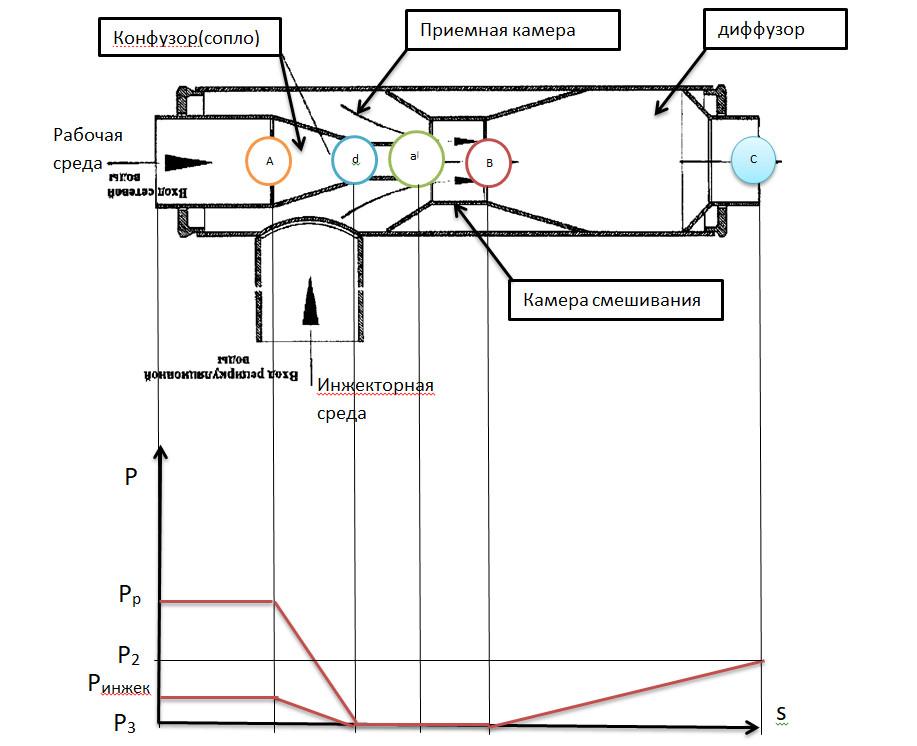
28.
Струйные аппараты. Принцип работы. Схема
аппарата. Коэффициент инжекции.
Изображение в i-s
координатах.
Струйные
аппараты
— где происходит смешение и обмен энергии
двух потоков и имеющих разные давление.
При
прохождении сопла скорость потока
увеличивается, давление уменьшается.
Поток имеющий более высокое давление
рабочий
поток.
Поток имеющий более низкое давление
инжектированный.
Такой
аппарат используется для увеличения
температуры пара, для удаления воздуха
из аппарата создание и поддержание
вакуума, подачи воды с колодцев и т.д
Струйные
аппараты более надежды по сравнению с
механическими нагнетательными аппаратами,
но менее экономичны.
Потоки
смеси..
aa|—
расширение рабочей среды при прохождении
сопла
dd|—
расширение инжекторной среды
aвd|—
смешение потока
aа|a
–повышения давления потока в диффузоре
Коэффициент
инжекции рассчитывается :
29.
Цикл идеального компрессора одноступенчатого
и многоступенчатого. Расчет мощности
и отводимой теплоты. Изображение в p-v
и T-s
диаграммах.
30.
Особенности реального компрессора и
их учет.
31.
Методы получения низких температур.
основные параметры характеризующие
работу холодильной установки. Обратный
цикл Карно.
32.
Воздушная холодильная установка. Схема
установки. Расчет основных характеристик.
Изображение в T-s
и p-i
диаграммах.
33.
Парокомпрессионная холодильная
установка. Схема установки. Расчет
основных характеристик. Изображение в
p-v
и T-s
диаграммах.
34.
Парокомпрессионная холодильная
установка. Схема установки. Виды циклов
и их изображение в T-s
диаграмме. Требование к хладагентам.
35.
Парокомпрессионная холодильная
установка. Схема установки. Изображение
холодопроизводительности и затраченной
работы в p-v
и T-s
диаграммах. Влияние температуры испарения
и температуры конденсации на температурный
коэффициент.
36.
Абсорбционная холодильная установка.
Схема установки. Принцип работы.
Коэффициент использования теплоты.
37.
пароэжекторная холодильная установка.
Схема установки. Изображения в Т-s
диаграмме.
38.
Термотрансформаторы. Принцип работы.
Коэффициент преобразования теплоты.
39.
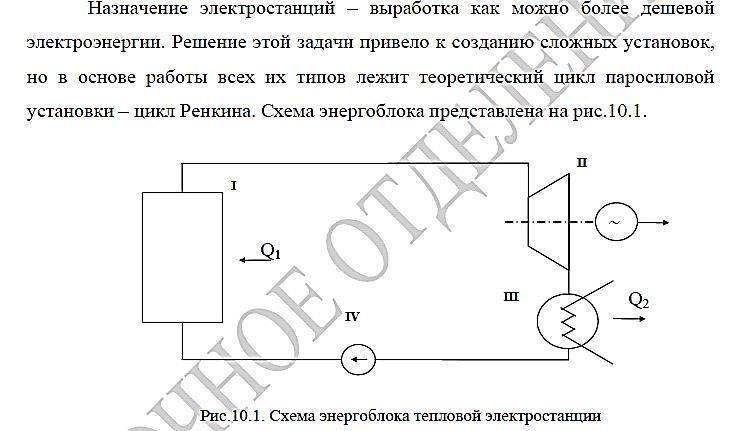
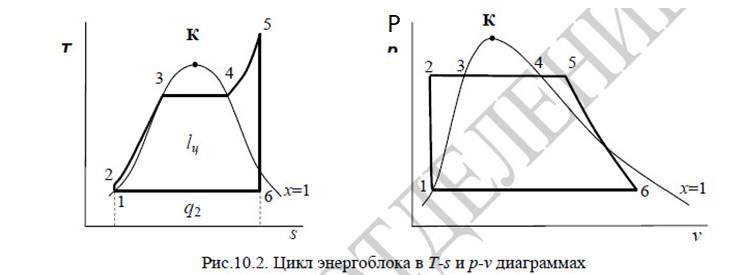
Промышленное производство энергии.
Цикл Райкина. Схема установки. Расчёт
основных характеристик. Изображение в
T-s
координатах. Влияние температуры и
температуры конденсации на КПД.
Промышленное
производство энергии
Цикл
Райкина
Схема
установки.
Пояснение
к схеме:
Изображение
в T-s
координатах
*из
лекций
2-5
– на этом участке мы подводим теплоту,
p=const
, q1=i5-i2
5-6
S=0,
q=0
, lп=i5-i6
Расчёт
основных характеристик.
-
из
лекций
КПД
прямого цикла
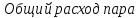
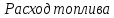
40.
Влажный воздух. Кондиционирование
воздуха в зимнее и летнее время.
41.
Влажный воздух. Конвективная сушка.
Тепловой кпд сушилки.
42.
Циклы тепловых двигателей. Основные
допущения, используемые при анализе
циклов. невозможность реализации цикла
с высоким КПД. Сравнения циклов Отто и
Дизеля.
43.
Циклы газовой турбины. Схема установки.
КПД цикла. Сравнение с циклами Отто и
Дизеля.
44.
Первичные источники энергии. Их
характеристики. Основные энергоемкие
процессы.
45.
Вторичные энергоресурсы. Классификация.
Повышение потенциала ВЭР. Примеры
использования (многокорпусное
выпаривание…и что-то еще)
Классификация.
По
виду
-
Тепловая
(энергия потоков) -
Горючие
вещества -
Потоки
имеющие высокое давление
По
схеме использования
1)
Внутренние – ресурсы используются в
одной и той же установке
2)
Разомкнутая
3)
Комбинированная
Повышение
потенциала ВЭР
1)
с помощью смешения с высококачественным
топливом
2)
Сжатие водяного пара
Примеры:
1.
Подогрев материала потоков при подходе
к установке
2.
Процесс получение кокса. (используется
вторичный газ вместо воды)
3.
Примеры выпаривания
процесс
увеличения концентрации растворов не
летучих веществ, удалние испарения при
кипении.
Соседние файлы в папке экзамен
- #
- #
- #
- #
1.Границы применимости термодинамики.
2.Термодинамическая система, внутренняя энергия, формы взаимодействия (теплота и работа), термодинамические степени свободы, термомеханическая система
3.Первое начало термодинамики и его уравнение
4.Характеристики состояния, независимые переменные, функции состояния, параметры состояния
5.Потенциалы и координаты взаимодействия, уравнения состояния, поверхность состояний.
6.Критерии стабильности, уравнение состояния идеального газа
7.Термодинамический процесс. Равновесный (обратимый) процесс. Графическое представление процесса. Уравнение процесса.
8.Наравновесность, необратимость.
9.Выражение работы и теплоты через характеристики состояния. Рабочая и тепловая диаграммы.
10.Зависимость количества теплоты и работы от характера процесса. Основное уравнение термодинамики
11.Теплоемкость. Удельная теплоемкость: массовая, объемная, молярная. Истинная и средняя теплоемкость.
12.Зависимость теплоемкости от характера процесса. Теплоемкости Ср и Сv идеального газа и связь между ними. Вычисление средней теплоемкости для интервала температур.
13.Располагаемая работа, ее выражение через параметры состояния и представление в координатах РV
14.Термодинамические процессы. Понятие политропного процесса. Анализ политропного процесса (в его частных случаях: изохорного, изобарного, изотермического, адиабатного).
15.Особенности термодинамического анализа процессов.
16.Вычисление неизмеряемых функций состояния: внутренней энергии, энтальпии, энтропии идеального газа.
17.Циклы: прямой и обратный. Термический и холодильный кпд. Цикл и теорема Карно.
18.Особенности равновесных и неравновесных превращений теплоты и работы
19.Второе начало термодинамики – закон о неравновесных (необратимых) процессах (принцип возрастания энтропии). Физический смысл аналитического выражения второго начала. Второе начало и принцип существования энтропии
20.Связь энтропии и вероятности состояния.
21.Истечение газов. Установившееся одномерное течение газов. Основное уравнение истечения. Адиабатное истечение газа из сосуда неограниченной емкости. Сопло Лаваля.
22.Абсолютная шкала температуры.
23.Метод термодинамических потенциалов.
24.Связь теории тепломассообмена и термодинамики, область применимости теории тепломассобмена.
25.Основные понятия теории тепломассообмена: поле температуры, её градиент, гипотеза Фурье. Гипотеза Ньютона. Коэффициент теплоотдачи.
26.Уравнение Фурье-Кирхгофа.
27.Условия однозначности для расчета задач теплопроводности
28.Решение уравнения Фурье-Кирхгофа для одномерных стационарных задач без источников внутреннего тепловыделения: плоская стенка с граничными условиями 1-го, 2-го и 3-го рода (постановка задачи – дифференциальное уравнение и условия однозначности, решение)
29.Решение уравнения Фурье-Кирхгофа для одномерных стационарных задач без источников внутреннего тепловыделения: цилиндрическая стенка с граничными условиями 1-го, 2-го и 3-го рода (постановка задачи – дифференциальное уравнение и условия однозначности, решение)
30.Решение уравнения Фурье-Кирхгофа для одномерной стационарной задачи с источником внутреннего тепловыделения (на примере цилиндрической геометрии)
31.Тепловое сопротивление составной плоской и цилиндрической стенки. Критическая толщина изоляции.
32.Принципы расчета нестационарной конвекции
33.Математическое описание конвективного теплообмена в среде: уравнения энергии, движения, неразрывности (без вывода).
34.Условия однозначности для расчета конвекции.
35.Применение метода анализа размерностей, π-теорема.
36.Применение теории подобия для анализа конвективного теплообмена
37.Основные критерии подобия, число Нуссельта.
38.Теплообмен излучением: определение и основные законы.
Вопросы для подготовки к зачету по теме «Основы молекулярной физики и термодинамика»
14. Основные положения МКТ. Диффузия и броуновское движение.
15. Размеры и масса молекул. Количество вещества. Молярная масса. Число Авогадро.
16. Идеальный газ, его основные свойства. Давление газа, единицы давления.
17. Парообразование и конденсация. Испарение. Кипение.
18. Насыщенный пар и его свойства. Влажность воздуха и ее измерение.
19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения жидкости. Явления смачивания и не смачивания. Краевой угол.
20. Понятия кристаллического и аморфного тел. Виды кристаллических решёток. Плавление и кристаллизация твёрдых тел.
Ответы.
Часть 1. Основные физические величины, единицы их измерения, формулы для нахождения.
Часть 2. Основные понятия.
1. Основные положения МКТ.
- Все тела состоят из мельчайших частиц – атомов, молекул, между которыми есть промежутки. Строение любого вещества дискретно (прерывисто).
- Атомы и молекулы вещества находятся в непрерывном хаотическом движении.
- Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Диффузией называют явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого. Т.е. это самопроизвольное перемешивание веществ.
Броуновское движение — тепловое движение взвешенных в жидкости (или газе) частиц.
4. Молекула. Размеры и масса молекул.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Размеры молекул очень малы.
Порядок величины диаметра молекулы 1*10—8 см = 1*10—10 м
Порядок величины объёма молекулы 1*10—20 м3
Порядок величины массы молекул 1*10-23 г = 1*10-26кг
Количество вещества ע – это физическая величина, показывающая, во сколько раз число молекул в данном веществе больше, чем число атомов в 12 г углерода. Оно равно отношению числа молекул (атомов) (N) в данном макроскопическом теле к числу молекул в 12 г углерода (NA)
Единица измерения — 1 моль
Молярная масса — масса вещества, взятого в количестве 1 моль.
M=m0·NA
Единица измерения — 1 кг/моль.
Значение молярной массы для каждого элемента можно узнать в таблице Менделеева.
Один моль любого вещества содержит одинаковое число молекул.
Постоянная Авогадро — число молекул в 1 моле любого вещества.
NA =6, 02 * 1023моль -1
8. Идеальный газ, его свойства.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения между молекулами стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул происходит по законам Ньютона.
9. Давление газа, единицы давления.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
10. Парообразование и конденсация.
Парообразование — переход вещества из жидкого состояния в газообразное.
Происходит двумя путями: испарением и кипением.
Конденсация — переход вещества из газообразного состояния в жидкое.
Для того, чтобы превратить в пар при неизменной температуре жидкость массой m, ей необходимо сообщить количество теплоты, равное Qп = L·m
L – удельная теплота парообразования
При конденсации выделяется количество теплоты, равное Qк = — L·m
Испарение — это парообразование, происходящее со свободной поверхности жидкости.
Скорость испарения зависит:
- от рода жидкости (эфир и вода);
- от площади её свободной поверхности (чем больше площадь, тем быстрее испаряется жидкость – блюдце и стакан);
- от температуры (чем выше температура, тем быстрее испаряется жидкость – лужи зимой и летом);
- от наличия движения воздуха над поверхностью (в ветреную погоду и в безветренную).
Кипение — это парообразование, которое происходит в объеме всей жидкости при постоянной температуре.
12. Насыщенный пар и его свойства.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
Свойства насыщенного пара:
1. Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Если уменьшить объем насыщенного пара, то сначала концентрация его молекул увеличится и из газа в жидкость начнет переходить больше молекул до тех пор, пока опять на установится динамическое равновесие.
2. Давление насыщенного пара при постоянной температуре не зависит от его объёма.
p = n·k·T, т.к. n не зависит от V , то и р не зависит от V.
Независимое от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара. Это наибольшее давление, которое может иметь пар при данной температуре.
3. Давление насыщенного пара зависит от температуры. Чем выше будет температура жидкости, тем больше молекул будет испаряться, динамическое равновесие нарушится, но концентрация молекул пара будет расти до тех пор, пока равновесие не установится опять, а значит, больше станет и давление насыщенного пара. С увеличением температуры давление насыщенных паров возрастает.
13. Влажность воздуха и ее измерение.
Воздух, содержащий водяной пар, называют влажным.
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха. Она равна парциальному давлению пара при данной температуре.
Парциальное давление пара – это давление, которое оказывал бы водяной пар, находящийся в воздух , если бы все остальные газы отсутствовали.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
Для измерения влажности воздуха используют приборы гигрометры и психрометры.
14. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения жидкости.
Чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил Aвнеш, пропорциональную изменению ΔS площади поверхности:
Aвнеш = σΔS
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0) или просто поверхностным натяжением.
σ = А/ΔS
Коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Коэффициент поверхностного натяжения σ зависит
- от рода жидкости;
- от наличия примесей;
- от температуры.
Поверхностное натяжение это физическая величина, равная отношению силы поверхностного натяжения F, приложенной к границе поверхностного слоя жидкости и направленной по касательной к поверхности, к длине L этой границы.
σ = Fк / L
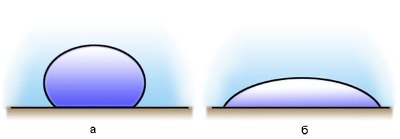
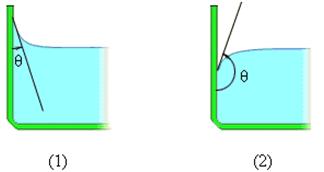
15. Явления смачивания и не смачивания. Краевой угол.
Если капли воды поместить на поверхность чистого стекла, то они будут растекаться, а если на жирную поверхность, то они примут форму, близкую к форме шара.
Если силы взаимодействия молекул жидкости с молекулами твердого тела больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. (случай с каплями воды на стекле)
В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом θ, характерным для данной пары жидкость – твердое тело. Угол θ называется краевым углом.
Краевой угол – угол между поверхностью твердого тела и касательной к поверхности жидкости в точке соприкосновения.
Краевые углы смачивающей (1) и несмачивающей (2) жидкостей.
Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то жидкость не смачивает поверхность твердого тела. (случай с каплями воды на жирной поверхности, ртутью на стекле)
В этом случае краевой угол θ оказывается тупым (рис. 1).
При смачивании θ < 0 (острый), при несмачивании θ > 0 (тупой). При полном смачивании θ = 0, при полном несмачиванииθ = 180°.
16. Понятия кристаллического и аморфного тел.
Твёрдые тела — вещества, длительное время сохраняющие свою форму и объём.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – кристаллические и аморфные тела.
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Молекулы и атомы в аморфных телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц мала. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), воск, смола, пластики и т. д.
17. Виды кристаллических решёток.
В зависимости от характера сил взаимодействия и природы частиц, находящихся в узлах кристаллической решетки, различают четыре типа кристаллических решеток.
1. Ионные кристаллы. В узлах кристаллической решетки находятся ионы (положительно и отрицательно заряженные) атомов, которые входят в состав молекулы данного вещества. Связь между ними обусловлена электрическими (кулоновскими) силами взаимодействия (притяжения) между разноименными ионами.
Примером ионной решетки служит кристалл каменной соли NaCl.
2. Атомные кристаллы. В узлах кристаллической решетки находятся нейтральные атомы. Между ними существует ковалентная связь (связь, при которой каждые два соседних атома удерживаются рядом силами притяжения, возникающими при взаимном обмене между этими атомами двумя валентными электронами).
Примером атомных кристаллов являются алмаз, графит, германий, кремний.
3. Молекулярные кристаллы. В узлах кристаллической решетки находятся молекулы, ориентированные определенным образом. Между молекулами действуют силы притяжения, характерные для взаимодействия молекул.
К молекулярным кристаллам относятся нафталин, парафин, сухой лед СО2, лед Н2О.
4. Металлические кристаллы. В узлах кристаллической решетки находятся положительные ионы металла, между которыми движутся свободные (валентные) электроны, образующие электронный газ. Связь в металлических кристаллах обеспечивается силами притяжения между положительными ионами, находящимися в узлах решетки, и отрицательным электронным газом.Эти силы притяжения уравновешиваются силами отталкивания между одноименными ионами.
18. Плавление и кристаллизация твёрдых тел.
Плавление – переход вещества из твердого состояния в жидкое.
При плавлении температура тела остается постоянной. Все переданное телу тепло идет на разрушение кристалла.
Чтобы перевести в жидкость твердое тело массой m при температуре плавления, ему надо сообщить количество теплоты
Q = λ m
где λ – удельная теплота плавления.
Кристаллизация (отвердевание) – переход вещества из жидкого состояния в твердое
При кристаллизации происходит выделение количества теплоты
Q = -λ m
19. Первый закон термодинамики.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5