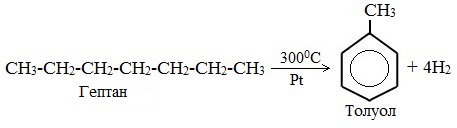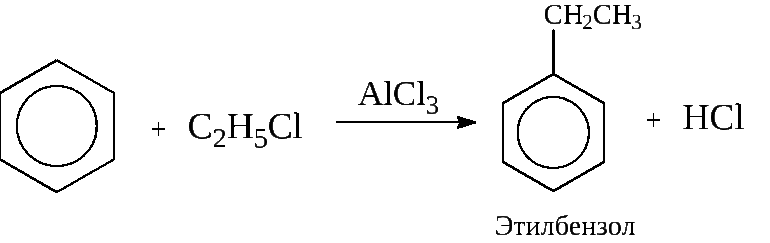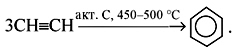Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) в качестве отбеливателя
2) в качестве удобрения
3) в качестве топлива
4) в качестве растворителя
Запишите в таблицу выбранные цифры под соответствующими буквами.
Спрятать решение
Решение.
А. Перекись водорода благодаря своим сильным окислительным свойствам используется в качестве отбеливателя. (1)
Б. Толуол смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, поэтому используется в качестве растворителя. (4)
В. Метан (основная составная часть природного газа) может быть использован в виде топлива как в сжатом, так и в сжиженном виде. (3)
Ответ: 143.
Источник: ЕГЭ по химии 2019. Досрочная волна
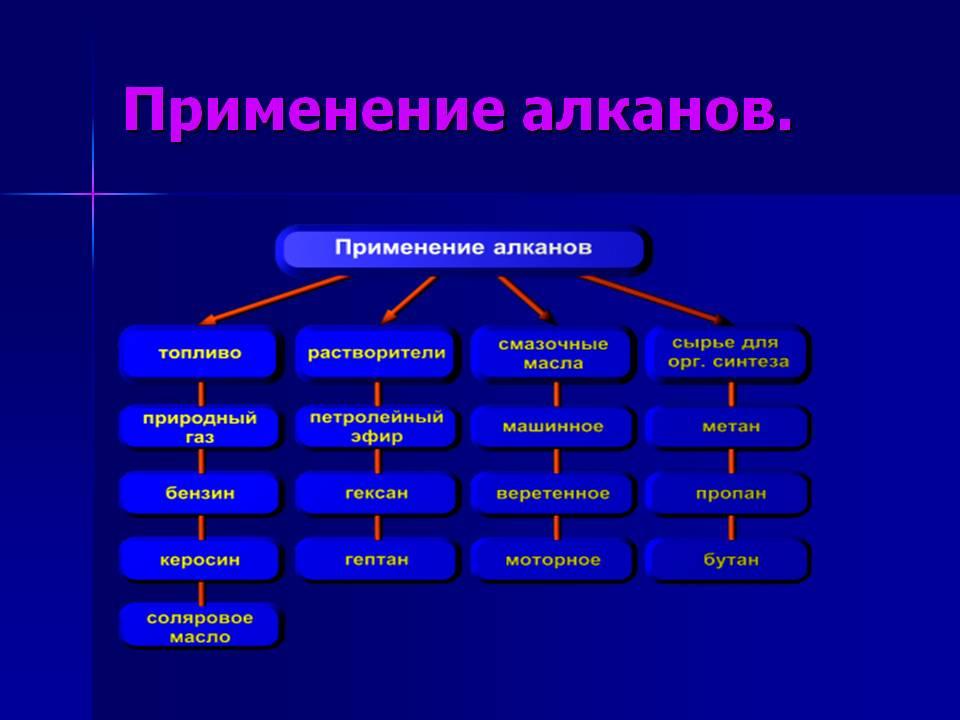
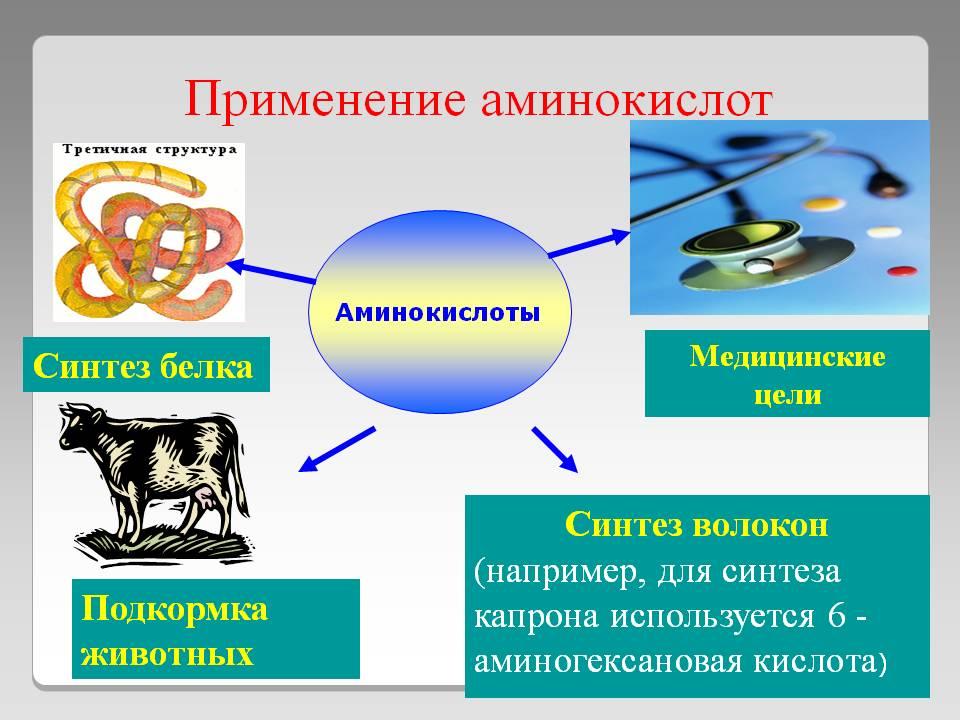
Применение
веществ
Органика
Алканы
Алканы
используются при изготовлении каучука,
синтетических тканей, пластмасс,
поверхностно-активных веществ.
Пропан,
бутан – исп-ся в качестве заправки
баллонов для тушения пожаров в сжиженном
виде
Пропан-бутановая
— смесь в зажигалках
Пропан
— баллоны для дачи
Алканы-газы
– в качестве пропеллентов для изготовления
аэрозолей
СН4
– горючее для газовых плит
С5-С19
– бензин, керосин, смеси для розжига,
топливо
С20
и далее – свечи
С₁₈Н₃₈
до С₃₅Н₇₂ (парафин) — Изготовление
вазелинового масла (смесь жидких
алканов), вазелина (смесь жидких и твёрдых
алканов), свечей, моющих средств, лаков,
эмалей, мыла. В качестве пропитки спичек.
Использование при производстве
органических кислот. В качестве пропитки
упаковочной бумаги. Производство
жевательных резинок
Хлорпроизводные
алканов — изготовление спиртов, альдегидов,
кислот, РАСТВОРИТЕЛИ
Алкены
Циклоалканы
Циклопропан
– анестетик
Циклопентан
— добавка к моторному топливу для
повышения качества.
Циклогексан
используется для синтеза полупродуктов
при производстве синтетических волокон
нейлона и капрона, для получения
циклогексанола, циклогексанона,
адипиновой кислоты, а также в качестве
растворителя.
Алкины
Ацетилен
– газовая сварка, получение технического
карбона; прим-ся в автономных светильниках
и при производстве ракетного топлива
Алкадиены
Синтез
каучуков => пол-е резины, эбонита (не
проводит эл. ток, исп-ся для изоляции),
пвх и т.д.
Бензол
Применяется
в синтезе современных отхаркивающих
средств, препаратов для лечения кожных
заболеваний и других лекарств. В малых
количествах практически не обладает
токсичностью. Применяется в качестве
исходного реагента для синтеза. Он
эффективно растворяет смолы, масла,
жиры, йод и серу.
Бензойная
кислота
Снижает
активность ферментов в структуре
микробов их
Проявляет
дезинфицирующие свойства.
Это
качество нашло активное применение
бензойной кислоты и с успехом используется
для изготовления лекарственных составов
от кашля, отхаркивающих и антисептических
средств
Получение
фунгицид, применяющихся в сельском
хозяйстве для защиты разнообразных
культурных растений.
Консервавнт
Толуол
Лакокрасочные
материалы
Лаки
Краски
РАСТВОРИТЕЛЬ
полимеров
Спирты
—
В
органическом синтезе.
— Биотопливо,
добавки в топливо, ингредиент тормозной
жидкости, гидравлических жидкостей.
—
Растворители.
— Сырье для производства
ПАВ, полимеров, пестицидов, антифризов,
взрывчатых и отравляющих веществ,
бытовой химии.
— Душистые вещества
для парфюмерии. Входят в состав
косметических и медицинских средств.
—
Основа алкогольных напитков, растворитель
для эссенций; сахарозаменитель (маннит
и т.п.); краситель (лютеин), ароматизатор
(ментол).
Этиленгликоль
Производство
теплоносителей и охлаждающих жидкостей,
задачами которых является теплопередача
и теплоотвод соответственно. Производство
пластиковых бутылок. Производство
синтетических волокон. Производство
гидравлических жидкостей. Изготовление
лекарственных средств.
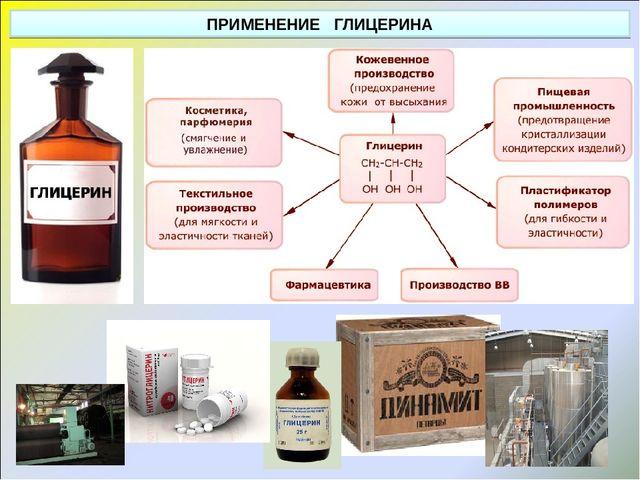
Глицерин
Фенол
АНТИСЕПТИКИ,
лекарства, заменители сахара, красители,
клеи, фенолформальдегидная смола
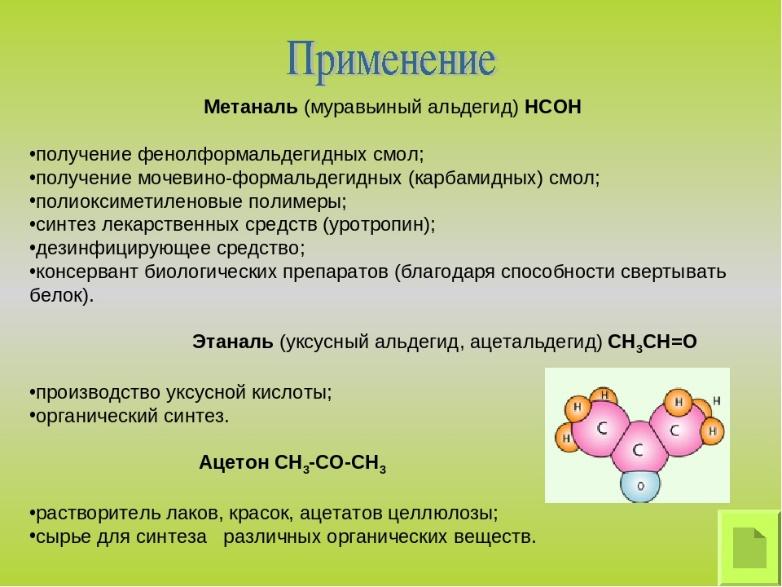
Альдегиды
и ацетон
Альдегиды
нашли широкое применение в качестве
сырья для синтеза различных продуктов.
Так, из формальдегида (крупнотоннажное
производство) получают различные смолы
(фенол-формальдегидные и т.д.), лекарственные
препараты (уротропин); ацетальдегид —
сырье для синтеза уксусной кислоты,
этанола, различных производных пиридина
и т.д. Многие альдегиды (масляный, коричный
и др.) используют в качестве ингредиентов
в парфюмерии
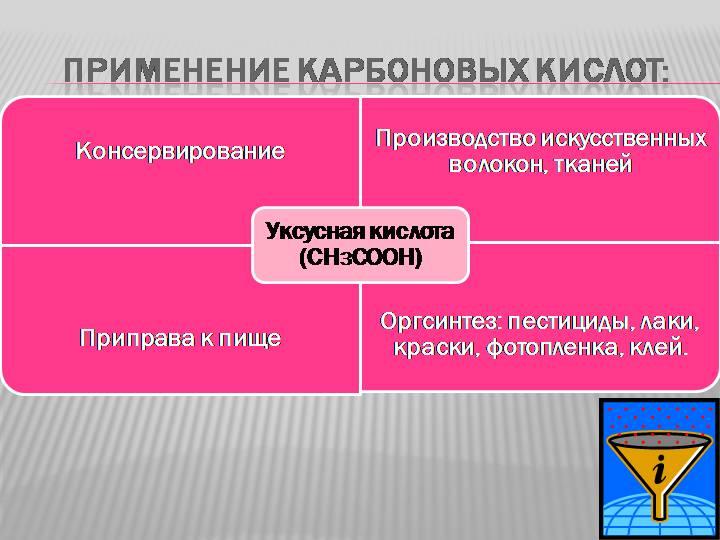
Карб
кислоты
Стеарат/пальмитат
натрия – мыло
Амины
Нитросоединения
Аминокислоты
Жиры
Неорганика
Нитраты
– азотсодержащие удобрения
Фосфат,
гидрофосфат кальция; суперфосфат –
фосфорные удобрения
SiO2
– керамика, стекло
S
– резина
NaHCO3
– разрыхлитель теста, чистящее средство
(NH4)2CO3
– разрыхлитель теста
С
акт. – поглотитель в фильтрах и при
отравлениях
ССl4
– растворитель
NH3
– пол-е удобрений, пол-е азотной к-ты
NH3*H2O
– стеклоочистительные ж-ти и при потере
сознания
O3
– Дезинфекция воды; обнаруживание KI
с крахмалом
Cl2
– Дезинфекция воды; обнаруживание KI
с крахмалом
Лимонная
кислота – удвление накипи с внутр.
пов-ти чайника
H2O2
– антисептик для ран
I2
— антисептик для ран; обнар-е крахмала
Толуол (толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол был впервые получен Пельтье в 1835 при перегонке сосновой смолы.
В 1838 выделен А.Девилем из толуанского бальзама — желтовато-коричневой, приятно пахнущей смолы южно-американского дерева, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Физические свойства толуола
Толуол – бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие, не растворимая в воде, хорошо растворяется в органических растворителях, растворяет полимеры. Температура кипения = 110,60С.
Обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей. Горюч, сгорает с выделением копоти. Толуол менее токсичен, чем бензол.
Пары толуола легко образуют взрывоопасные смеси, воспламеняющиеся даже от искры статического электричества.
Химические свойства толуола
Чем опасен толуол?
Получение
В промышленности
1. Переработка нефти и угля
В настоящее время, толуол получают из нефтяных фракций и каменноугольной смолы.
Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серусодержащих соединений) и выделяют ректификацией.
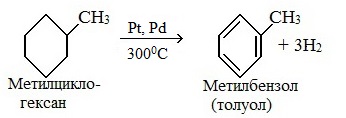
2. Дегидрирование метилциклогексана
3. Дегидроциклизация гептана
В лаборатории
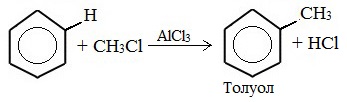
1. Алкилирование по Фриделю-Крафтсу
2. Реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана)
Применение толуола
Толуол – это ценное сырье для органического синтеза, для производства компонентов моторных топлив с высоким октановым числом, для получения взрывчатых веществ (тринитротолуола), фармацевтических препаратов, красителей и растворителей. Как основной компонент входит в состав растворителей.
|
Толуол |
|
|---|---|
| Хим. формула | C₇H₈ |
| Молярная масса | 92,14 г/моль |
| Плотность | 0,86694 г/см³ |
| Т. плав. | −95 ℃ |
| Т. кип. | 110,6 ℃ |
| Кр. точка | 320 °C (593 K), 4299 кПа |
| Удельная теплота испарения | 364 кДж/кг |
| Растворимость в воде | 14 мг/100 мл |
| ГОСТ | ГОСТ 5789-78 |
| Номер CAS | 108-88-3 |
| PubChem | 1140 |
| ChemSpider | 1108 |
| Номер EINECS | 203-625-9 |
| RTECS | XS5250000 |
| ChEBI | 17578 |
| DrugBank | DB11558 |
|
CC1=CC=CC=C1 |
|
|
1S/C7H8/c1-7-5-3-2-4-6-7/h2-6H,1H3 |
|
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. |
Толуол (от исп. Tolu, толуанский бальзам) — метилбензол, PhMe — бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пеллетье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Содержание
- 1 Общая характеристика
- 2 Химические свойства
- 3 Получение и очистка
- 4 Применение
- 5 Опасность и обращение
- 6 Толуоловая токсикомания
Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
- Взаимодействие с перманганатом калия в кислой среде:
- 5C6H5CH3 + 6KMnO4 + 9H2SO4 →
- → 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O
- Взаимодействие с перманганатом калия в нейтральной среде
- C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
- Взаимодействие с галогенами на свету
-
- C6H5CH3 + X2 →hν C6H5CH2X + HX
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол также образует с водой азеотропную смесь.
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
-
- C6H6 + CH3Br →FeBr3 C6H5CH3 + HBr
Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»).
Толуоловая токсикомания
Толуол и содержащие его смеси, например, Р-646 являются галлюциногенными веществами. Для борьбы против токсикомании фирма Хенкель исключила толуол из клея «Момент», заменив его ацетоном.
|
Углеводороды |
|
|---|---|
| Алканы |
|
| Алкены |
|
| Алкины |
|
| Диены |
|
| Другие ненасыщенные |
|
| Циклоалканы |
|
| Ароматические |
|
| Полициклические |
Декалин |
| Полициклические ароматические |
|
Физиологические качества
Толуол (метилбензол) считается мутной эмульсией с резким запахом, показывает слабое наркотическое влияние, нерастворим в воде, превосходно открывается в базовых растворителях, воздействует на полимеры. Температура полного кипения — 110.60 гр. Содержит сладковатый аромат, напоминающий запах красок, лаков. Горючее вещество коптит сажей. Метилбензол менее токсичен, чем бензол.
Улетучивания толуола запросто создают взрывоопасную консистенцию, которая воспламеняется, довольно искры от электроэнергии, чтобы стартовало горение. У толуола есть химическая формула: C7H8. Её вполне вероятно образовать любым способом: C6H5 — CH3. При этом количество атомов остаётся прежним.
Структурная основа
Состав базового продукта, состоящего лишь только из атомов углерода и водорода, демонстрирует формулу толуола. Между ним и бензолом есть однотипность, которая состоит в кольце из 6 углеродных атомов при гибридизации. В гомологах отличие от составляющих одного и того же соответствующего ряда есть.
Любая из составляющих формирует 3 сигма-связи с примыкающими частичками (2 атома углерода и 1 водорода). Отвесно кольцу есть только 1 система из негибридных P-орбиталей (единственная из 6 углеродных атомов). В итоге вещество получает свои свойства от пройденного цикла.
Уплотнённость между углеродными атомами, компонентами ядра, распределена пропорционально. Наружный вид отражается в бензольной формуле. Ключевая формула в этом случае отражает главные структурированные особенности молекулы. Метильная категория обладает возможностью быть в любом из 6 атомов ядра, они эквивалентны друг другу.
Получение этилбензола
Существует несколько типов технологических моделей, используемых для производства. Установки для создания бензола, за некоторыми исключениями, служат одновременно для получения толуола и ксилола (который либо разделяется в виде чистого продукта, либо алюминия на бензол). Выбор метода производства является стратегическим решением, которое зависит от доступного сырья, стоимости и спроса на рынке.
Сырье, используемое для производства ароматических соединений, пиролитического газа и риформиата, является побочным продуктом процесса производства олефинов и бензина, это также смесь фракций, которые можно разделить способом, который индивидуально выбран под конкретный состав сырья.
Наиболее распространенным методом отделения бензола от других компонентов, образующих азеотропную смесь, является сложный метод физического разделения, включая дистилляцию и экстракцию растворителем. Используются азеотропная, экстракционная перегонка, жидкокристаллическая кристаллизация и адсорбция на цеолитах. Установки для производства ароматизаторов, как правило, расположены вблизи комплексов нефтеперерабатывающего отделения.
Реакция окисления
Атомы водорода в молекулах могут быть реакцией замещения, что практически подготавливает арены. Метилбензол больше реактивен, чем бензол. Общее вещество характеризуется окислением. Горение связано с выделением углекислого газа и воды. С толуолом и калием метильная молярная категория в передней цепочке молекулы окисляется вплоть до алкилирования карбоновой кислоты.
В итоге взаимодействия с формулой толуола химические свойства могут меняться. Бромирование, которое проводят с катализаторами, выходит на галогенированное вещество. Нитрование бромтолуола осуществляется консистенцией, складывающейся из фиксированной серной и азотной кислот. Нитрогруппа толуола имеет возможность откликаться на орто- и параположение. Реакция идёт сообразно электрофильному замещению. При высочайшей температуре элемент может реагировать и бывает обнаружен взрывчатый бензойный тринитротолуол (ТНТ), который несет опасность.
Внедрение толуола
Вещество имеет многочисленные коммерческие и промышленные применения и является растворителем в красках, лаках, разбавителях, клеях, корректирующей жидкости для снятия лака, а также используется в процессах печати и дубления кожи.
Толуол химического качества является весомым сырьём для органического синтеза, изготовления высокооктановых составляющих моторных топлив, приготовления взрывчатых веществ, медицинских препаратов, красителей и растворителей. Как ведомый компонент он входит в состав лаков. Толуол молекулярный обширно применяется в качестве начального вещества в органическом синтезе и гидрировании. Это значительный элемент при дегидрировании большого числа веществ.
Использование толуола:
- получение красителя, полимеризация;
- создание пятновыводителей, моющих веществ;
- создание тротила;
- изготовление клеев искусственного происхождения, чистящих на базе растворителя;
- разработка красок;
- продукты для ногтей;
- создание медпрепаратов;
- получение горючего.
Метилбензол действует как индустриальный класс растворителя, применяющийся в различной работе. Он видится предшественником части нефтепродуктов, оксибензола, метанола, пестицидов и иных сочетаний. Толуол больше нужен как растворитель и разбавитель для всех химикатов.
Он сокращает микровязкость покрытий, применяется для лаков и красок. Его сочетания могут вступать в реакцию при многих производствах. Растворители присваивают краске особенную густоту, уничтожают твёрдые вещества (сухой лак). Метилбензол растворяет полимер.
Используется вещество в базовом синтезе, парфюмерии и косметологии, военной промышленности, топливной, врачебной, лакокрасочной индустрии. Метилбензол, изготовленный по ГОСТу, доступен для реализации и имеет возможность применяться в будничной жизни. Высочайшая токсичность у метилбензола, он является горючим материалом. Паровоздушная смесь взрывается под определённым воздействием. Изомер огнеопасен.
Структурная формула акцентирует представление о составе и текстуре. Есть информация о действии на организм человека. Было определено, что метилбензол токсичен и владеет канцерогенным воздействием. Улетучивания его быстро попадают на кожу, в органы дыхания, провоцируют изменения в нервной системе, недоброкачественность покрова, воспаление.
При вдыхании нефтяных паров у человека отмечается затормаживание, трепет, нарушается работа вестибулярного аппарата. При работе с толуолом, красками, растворителями надо всё делать в резиновых перчатках, хорошо проветривать здание. Метилбензол считается наркотическим веществом, вызывающим подневольность при злоупотреблении.
Иные побочные эффекты:
- нарушения у человека зрения;
- утрата слуха;
- высочайшее сосредоточение в крови порождает нарушение работы печени, почек;
- вдыхание паров увеличивает сонливость, способствует головной боли.
Значимость в применении
Толуол производится в больших количествах на нефтезаводах или же в качестве второстепенного продукта на коксохимических предприятиях и имеет различную плотность, массу. Он считается важным сырьём для крупномасштабного органического синтеза, применяемого в фармацевтической индустрии.
Метилбензол не опасается света и выпускается буквально во всех формах растворителей, что применяются при работе с красками. При работе с материалом сосредоточение его паров в атмосфере не должно превышать показателей, определённых санитарно-гигиеническими общепринятыми стандартами.
При работе с толуолом у открытого огня искру предотвратить нельзя, и это может послужить предпосылкой для взрыва. Нужно быть осторожными.
Вещество воздействует на экологию, и это связано с выбросом его в атмосферу:
- при сжигании всевозможных видов горючего в находящейся вокруг среде;
- в действующих интенсивных вулканах;
- при лесных пожарах;
- при применении растворителей и красок.
Ядовитые качества толуола небезопасны для самочувствия человека, вследствие этого его надо использовать с предосторожностью.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Чтобы поделиться, нажимайте
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C6H5-COONa + NaOH t → C6H6 + Na2CO3
бензоат натрия
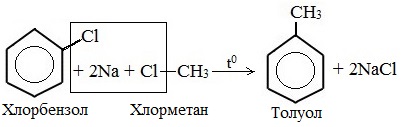
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5—R + 2NaГ
С6H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2

2. Тримеризация ацетилена (только для бензола) – р. Зелинского:
3С2H2 600°C, акт. уголь → C6H6
3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C6H12 t, kat→ C6H6 + 3H2

C6H11—CH3 t, kat→ C6H5—CH3 + 3H2
метилциклогексан толуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса.
C6H6 + C2H5-Cl t, AlCl3→ C6H5-C2H5 + HCl
хлорэтан этилбензол
Применение ароматических углеводородов
Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара- ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
п-Ксилол используется при получении полимерного материала лавсан, из которого изготавливают синтетические волокна и пленки.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.