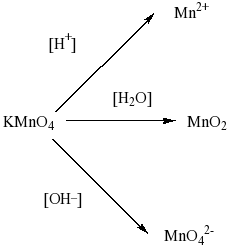
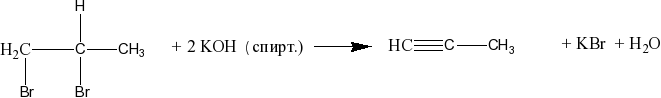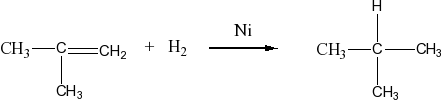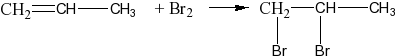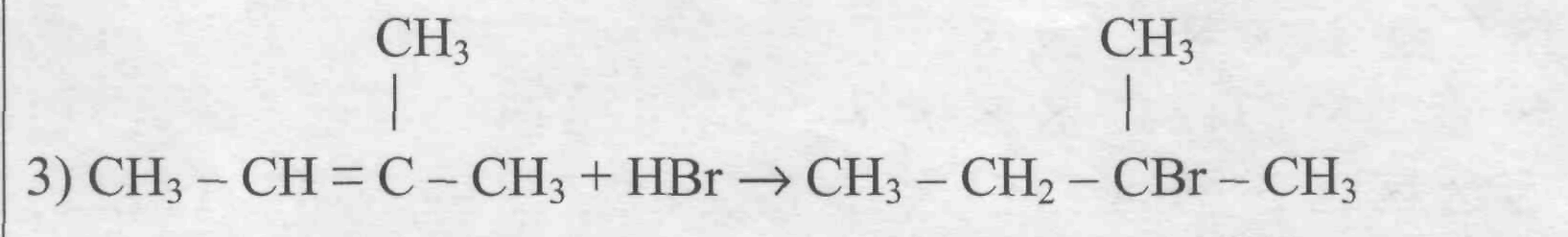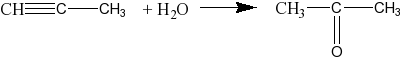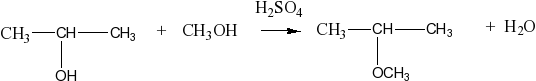Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Все сложные неорганические реакции из реальных заданий ЕГЭ по химии.
Практически все сложные неорганические реакции на ЕГЭ будут либо те же, либо полностью аналогичные.
neorganicheskie-reakcii.pdf
1)
Si + 2Cl2
→SiCl4
2)
SiCl4
+
3H2O→
H2SiO3
+
4HCl
3)
Ca3(PO4)2
+
5C + 3SiO2
→2P
+ 5CO + 3CaSiO3
4)
Ca3N2
+
6H2O→
3Ca(OH)2
+
2NH3↑
5)
2NH3
+
3CuO→
3Cu + 3H2O
+ N2↑
6)
Cu + 4HNO3(конц→.)
Cu(NO3)2
+
2NO2↑
+
2H2O
7)
2Cu(NO3)2
→2CuO
+ 4NO2
+
O2↑

4FeS + 7O2
→2Fe2O3
+
4SO2↑
9)
2H2S
+ SO2
→3S↓
+
2H2O
10)
S + 6HNO3
→H2SO4
+
6NO2↑
+
2H2O
11)
4Al(NO3)3
→2Al2O3
+
12NO2↑
+
3O2↑
12)
2Al2O3
→4Al
+ 3O2↑
(электролиз
раствора Al2O3
в
расплаве криолита)
13)
3KNO3
+
8Al + 5KOH + 18H2O
→3NH3↑
+
8K[Al(OH)4]
14)
CrO3
+
2KOH →K2CrO4
+
H2O
15)
2K2CrO4
+
H2SO4
→K2Cr2O7
+
K2SO4
+
H2O
16)
14HBr + K2Cr2O7
→2CrBr3
+
3Br2
+
7H2O
+ 2KBr
17)
H2S
+ Br2→
S↓
+
2HBr
18)
3Mg + N2
→Mg3N2
19)
Mg3N2
+
6H2O→
3Mg(OH)2↓
+
2NH3↑
20)
Cr2(SO4)3
+
6NH3
+
6H2O→
2Cr(OH)3↓
+
3(NH4)2SO4
21)
2Cr(OH)3
+
4KOH + 3H2O2
→2K2CrO4
+
8H2O
22)
2Ag + 2H2SO4(конц.)
→Ag2SO4
+
SO2↑
+
2H2O
23)
2KClO3
→2KCl
+ 3O2↑
(в
присутствии кат-ра)
24)
3Fe + 2O2
→Fe3O4
25)
Fe3O4
+
8HCl →FeCl2
+
2FeCl3
+
4H2O
26)
6FeCl2
+
14HCl + K2Cr2O7
→6FeCl3
+
2CrCl3
+
2KCl + 7H2O
27)
2Na + H2
→2NaH
28)
NaH + H2O→
NaOH + H2↑
29)
2NO2
+
2NaOH →NaNO2
+
NaNO3
+
H2O
30)
2Al + 2NaOH + 6H2O
→2Na[Al(OH)4]
+ 3H2↑
31)
Cu + 2H2SO4
→CuSO4
+
SO2↑
+
2H2O
32)
2CuSO4
+
4KI →2CuI↓
+
I2↓
+
2K2SO4
33)
2NaCl + 2H2O
→H2↑
+
Cl2↑
+
2NaOH (электролиз
раствора)
34)
Fe2O3
+
6HI →2FeI2
+
I2↓
+
3H2O
35)
Na[Al(OH)4]
+ CO2→
NaHCO3
+
Al(OH)3↓
36)
Al2O3
+
Na2CO3
(тв.)
→
2NaAlO2
+
CO2↑
(сплавление)
37)
Al4C3
+
12HBr →4AlBr3
+
3CH4↑
38)
2AlBr3
+
3K2SO3
+
3H2O
→2Al(OH)3↓
+
3SO2↑
+
6KBr
39)
3SO2
+
K2Cr2O7
+
H2SO4
→K2SO4
+
Cr2(SO4)3
+
H2O
40)
Zn + 2KOH + 2H2O
→K2[Zn(OH)4]
+ H2↑
41)
K2[Zn(OH)4]
→K2ZnO2
+
2H2O
42)
K2ZnO2
+
4HCl→
2KCl + ZnCl2
+
2H2O
43)
HI + KHCO3
→KI
+ H2O
+ CO2↑
44)
6KI + K2Cr2O7
+
7H2SO4
→4K2SO4
+
3I2↓
+
Cr2(SO4)3
+
7H2O
45)
2AlI3
+
3Na2S
+ 6H2O→
2Al(OH)3↓
+
3H2S↑
+
6NaI
46)
Fe3O4
+
10HNO3→
3Fe(NO3)3
+
NO2↑
+
5H2O
47)
Fe2O3
+
Fe →3FeO
48)
2Na + O2→
Na2O2
(горение)
49)
Na2O2
+
4HCl →2NaCl
+ 2H2O
+ Cl2↑
50)
3Cl2
+
10KOH + Cr2O3
→2K2CrO4
+
6KCl + 5H2O
51)
K2CrO4
+
BaCl2
→BaCrO4↓
+
2KCl
52)
2Cu(NO3)2
+
2H2O
→2Cu
+ O2↑
+
4HNO3
(электролиз
раствора)
53)
6KOH + 3S→
K2SO3
+
2K2S
+ 3H2O
54)
6KHCO3
+
Fe2(SO4)3
→2Fe(OH)3↓
+
3K2SO4
+
6CO2↑
55)
KH + H2O
→KOH
+ H2↑
56)
K2ZnO2
+
2H2SO4
→K2SO4
+
ZnSO4
+
2H2O
57)
FeSO4
+
2NH3
+
2H2O→
Fe(OH)2↓
+
(NH4)2SO4
58)
Fe(OH)2
+
4HNO3(конц.)
→Fe(NO3)3
+
NO2↑
+
3H2O
59)
2Fe(NO3)3
+
3K2CO3
+
3H2O
→2Fe(OH)3↓
+
3CO2↑
+
6KNO3
60)
4NO2
+
2Ca(OH)2
→Ca(NO3)2
+
Ca(NO2)2
+
2H2O
61)
3Ca + 2P →Ca3P2
62)
Ca3P2
+
6H2O
→3Ca(OH)2
+
2PH3↑
63)
PH3
+
8NaMnO4
+
11NaOH→
8Na2MnO4
+
Na3PO4
+
7H2O
64)
Na2MnO4
+
Na2SO3
+
H2O
→MnO2↓
+
Na2SO4
+
2NaOH
65)
P + 5HNO3→
H3PO4
+
5NO2↑
+
H2O
66)
4Zn + 2NO2
→4ZnO
+ N2↑
67)
2NaNO3
→2NaNO2
+
O2↑
68)
NaNO2
+
NH4I
→NaI
+ N2↑
+
2H2O
69)
2NaI + H2O2
+
H2SO4→
Na2SO4
+
I2↓
+
2H2O
70)
3I2
+
6NaOH(р−р)
→
NaIO3
+
5NaI + 3H2O
71)
H2O2
+
Ag2O
→2Ag↓
+
O2↑
+
H2O
72)
2ZnS + 3O2
→2ZnO
+ 2SO2↑
73)
Na2[Zn(OH)4]
→
Na2ZnO2
+
2H2O
74)
3Cu2O
+ Na2Cr2O7
+
10H2SO4
→6CuSO4
+
Cr2(SO4)3
+
Na2SO4
+
10H2O
75)
NaHCO3
+
NaOH→
Na2CO3
+
H2O
76)
K2Cr2O7(тв.)
+
14HCl(конц.
→)
2CrCl3
+
2KCl + 3Cl2↑
+
7H2O
77)
3NaNO2
+
2KMnO4
+
H2O
→2MnO2↓
+
2KOH + 3NaNO3
78)
MnO2
+
4HCl(конц.)
→MnCl2
+
Cl2↑
+
2H2O
79)
2Fe(OH)3
+
6HI →2FeI2
+
I2↓
+
6H2O
80)
3Na2CO3
+
2CrBr3
+
3H2O
→2Cr(OH)3↓
+
6NaBr + 3CO2↑
81)
5FeCl2
+
KMnO4
+
8HCl→
5FeCl3
+
MnCl2
+
KCl + 4H2O
82)
K2SiO3(р—р)
+
2H2O
+ 2CO2
→H2SiO3↓
+
2KHCO3
83)
Ba(OH)2
+
2NaHCO3→
Na2CO3
+
BaCO3↓
+
2H2O
(изб.
NaHCO3)
Ba(OH)2
+
NaHCO3
→BaCO3
+
NaOH + H2O
(изб.
Ba(OH)2)
или
84)
6KOH + 3Cl2→
KClO3
+
5KCl + 3H2O
85)
Cr2O3
+
KClO3
+
4KOH →2K2CrO4
+
KCl + 2H2O
86)
4NH3
+
5O2→
4NO
+ 6H2O
(кат.
Pt,
Cr2O3,
t, p)
87)
2NO + O2
→
2NO2
88)
NaNO2
+
2KMnO4
+
2KOH →2K2MnO4
+
NaNO3
+
H2O
89)
8KI(тв.)
+
9H2SO4(конц.
→)
8KHSO4
+
4I2↓
+
H2S↑
+
4H2O
90)
Al2O3
+
2NaOH + 3H2O→
2Na[Al(OH)4]
91)
Na[Al(OH)4]
+ 4HNO3
→NaNO3
+
Al(NO3)3
+
4H2O
92)
2Ca(OH)2
+
4NO2
+
O2
→2Ca(NO3)2
+
2H2O
93)
K[Al(OH)4]
+ SO2
→KHSO3
+
Al(OH)3↓
94)
8KOH + PCl5
→K3PO4
+
5KCl + 4H2O
95)
2KBr(тв)
+
2H2SO4(конц.,
гор.
→)
K2SO4
+
Br2
+
SO2↑
+
2H2O
96)
3Br2
+
6KOH→
5KBr + KBrO3
+
3H2O
97)
Br2
+
K2SO3
+
2NaOH →2NaBr
+ K2SO4
+
H2O
98)
Fe2O3
+
6HI →2FeI2
+
I2
+
3H2O
99)
Fe2O3
+
2NaOH(т→в.)
2NaFeO2
+
H2O
(сплавление)
100)
4NO2
+
O2
+
2H2O→
4HNO3
101)
NaFeO2
+
4HNO3(изб.)
→
NaNO3
+
Fe(NO3)3
+
2H2O
102)
FeO + 4HNO3(конц.)
→
Fe(NO3)3
+
NO2↑
+
2H2O
103)
Ca2Si
+ 4H2O→
2Ca(OH)2
+
SiH4↑
104)
3Na2SO3
+
Na2Cr2O7
+
4H2SO4→
Cr2(SO4)3
+
4Na2SO4
+
4H2O
105)
4Mg + 5H2SO4(конц.)
→
4MgSO4
+
H2S↑
+
4H2O
106)
CuS + 10HNO3→
Cu(NO3)2
+
H2SO4
+
8NO2
+
4H2O
CuS
+ 8HNO3(конц.)
→CuSO4
+
8NO2↑
+
4H2O
либо
(одинаково верно)
107)
3Cu + 8HNO3(разб.)
→3Cu(NO3)2
+
2NO↑
+
4H2O
108)
2Cu(NO3)2
+
2H2O→
2Cu↓
+
O2↑
+
4HNO3
(электролиз
раствора)
109)
Cu2O
+ 3H2SO4(конц.)
→2CuSO4
+
SO2↑
+
3H2O
110)
2NaI
+ 2NaMnO4
→I2↓
+
2Na2MnO4
(в
щелочном растворе)
111)
2Na2O2
+
2CO2
→2Na2CO3
+
O2
112)
8NaOH(р—р,
изб.)
+
Al2S3
→2Na[Al(OH)4]
+ 3Na2S
113)
4Ca + 5H2SO4(конц.)
→H2S↑
+
4CaSO4↓
+
4H2O
114)
2Fe(OH)2
+
H2O2
→2Fe(OH)3
115)
Na2O2
+
2H2O(хол.
→)
H2O2
+
2NaOH
116)
Ag2S
+ 10HNO3(конц.)
→
2AgNO3
+
H2SO4
+
8NO2
+
4H2O
Ag2S
+ 8HNO3
→Ag2SO4
+
8NO2
+
4H2O
117)
H2SO4
+
8HI →4I2
+
H2S
+ 4H2O
118)
H2SO4
+
2HBr→
Br2
+
SO2
↑
+
2H2O
119)
SO2
+
Cl2
+
2H2O→
H2SO4
+
2HCl (с
Br2
аналогично)
120)
PH3
+
8HNO3
→H3PO4
+
8NO2
↑
+
4H2O
121)
2FeSO4
+
2H2SO4
→Fe2(SO4)3
+
SO2
↑
+
2H2O
122)
2KMnO4
+
2NH3
→2KOH
+ N2
↑
+
2MnO2
+
2H2O
123)
2KMnO4
+
3(NH4)2SO3→
2MnO2
+
2(NH4)2SO4
+
K2SO4
+
2NH3
+
H2O
124)
(NH4)2SO3
+
Cl2
+
H2O
→
(NH4)2SO4
+
2HCl
125)
2Fe(OH)2
+
4H2SO4(конц.)
→
Fe2(SO4)3
+
SO2
+
6H2O
126)
NaHSO4
+
Ba(CH3COO)2
→
BaSO4
+
CH3COONa
+ CH3COOH
127)
2NaH2PO4
+
3Sr(OH)2
→
Sr3(PO4)2
+
2NaOH + 4H2O
128)
3Mg(H2PO4)2
+
12KOH→
Mg3(PO4)2
+
4K3PO4
+
12H2O
129)
5KClO3(тв.)
+
6P →
5KCl + 3P2O5
(при
сплавлении, не в растворе!)
130)
2KMnO4(подкисл.)
+
5SO2
+
2H2O
→
K2SO4
+
2MnSO4
+
2H2SO4
131)
K[Al(OH)4]
+ H2S
→
KHS + Al(OH)3
+
H2O
132)
3KHS + 2KMnO4
(изб.)
+
H2O
→
3S + 5KOH + 2MnO2
133)
Fe3O4
+
8HI →
3FeI2
+
I2
+
4H2O
134)
AlP + 3HCl→
AlCl3
+
PH3
135)
SO2
+
2HNO3
→
H2SO4
+
2NO2
136)
Cu2O
+ 6HNO3
(конц.
→)
2Cu(NO3)2
+
2NO2
+
3H2O
137)
3Ca(OH)2(изб.)
+
2(NH4)2HPO4→
Ca3(PO4)2
+
4NH3
+
6H2O
138)
2Na2CrO4
+
16HCl →4NaCl
+ 2CrCl3
+
3Cl2↑
+
8H2O
139)
4Na2Cr2O7
+
3PH3
+
16H2SO4
→4Na2SO4
+
4Cr2(SO4)3
+
3H3PO4
+
16H2O
140)
4Fe(NO3)2→
2Fe2O3
+
8NO2↑
+
O2↑
(как
в токе воздуха, так и без него)
141)
5Na2O2
+2KMnO4+8H2SO4→
5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O
142)
Ba(HSO3)2
+
2H2O2
→BaSO4
+
H2SO4
+
2H2O
143)
BaSO4(тв.)
+
4H2→
BaS
+ 4H2O
146)
SiH4
+
8KMnO4
+
10KOH→
8K2MnO4
+
K2SiO3
+
7H2O
144)
2FeS +10H2SO4
→Fe2(SO4)3
+
9SO2↑
+10H2O
145)
SiO2
+
4Mg →2MgO
+ Mg2Si
147)
8Cr(OH)3
+
3KClO4
+
16KOH →8K2CrO4
+
3KCl + 20H2O
148)
FeI2
+
6HNO3
(конц.)
→Fe(NO3)3
+
I2
+
3NO2↑
+
3H2O
149)
Cu2S
+ 6H2SO4(конц.)
→2CuSO4
+
5SO2↑+
6H2O
150)
Zn3P2
+
6HCl →3ZnCl2
+
2PH3↑
151)
2CuI + 8HNO3
(конц).
→
2Cu(NO3)2
+
I2
+
4NO2↑
+
4H2O
152)
2FeI2
+
6H2SO4
(конц.)
→Fe2(SO4)3
+
2I2
+
3SO2↑
+
6H2O
153)
Mg3P2
+
6H2O
→3Mg(OH)2
+
6PH3↑
154)
2K2MnO4
+
Cl2
→2KMnO4
+
2KCl
155)
FeS2
+
18HNO3
(конц.)
→
Fe(NO3)3
+
2H2SO4
+
15NO2↑
+
7H2O
156)
Na2S
+ 2NaNO2
+
2H2SO4→
2Na2SO4
+
S + 2NO↑
+
2H2O
157)
Cu2S
+ 14HNO3(конц.)
→2Cu(NO3)2
+
H2SO4
+
10NO2↑
+
6H2O
158)
Na2CrO4
+
2CH3COOAg→
2CH3COONa
+ Ag2CrO4↓
159)
2H2O
+ 2KMnO4
+
3Mn(NO3)2→
5MnO2↓
+
2KNO3
+
4HNO3
160)
Cu + 2KNO3
+
2H2SO4
↓→
CuSO4
+
K2SO4
+
2NO2
+
2H2O161)
C(АМОРФ.)
+
2H2SO4
→CO2↑
+
2SO2↑
+
2H2O
161)
C(АМОРФ.)
+
2H2SO4
→CO2↑
+
2SO2↑
+
2H2O
162)
10HNO3(конц.)
+
I2
→2HIO3
+
10NO2↑
+
4H2O
163)
3Na2O2
+
2NH3
→6NaOH
+ N2↑
164)
4H2SO4(конц.)
+
PH3
→H3PO4
+
4SO2↑
+4H2O
-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Неорганические реакции в ЕГЭ по химии
Неорганические реакции в ЕГЭ по химии
- 20.01.2020
Сборник неорганических реакций из реальных заданий ЕГЭ прошлых лет (по химии).
Собрано более 100 реакций, а также правильных ответов к ним.
Ценность в том, что задания взяты именно из реальных кимов ЕГЭ.
- Другая теория по химии для ЕГЭ
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #химияогэ #химик #егэхимия #химияегэ #репетиторпохимии
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Самые сложные реакции в ЕГЭ по химии | ХИМИЯ ЕГЭ | Лия Менделеева
Лия Менделеева — ЕГЭ химия

Самые сложные ОВР в задании 29 | Химия ЕГЭ | Parta
Parta химия ЕГЭ

Хром и марганец — самые сложные элементы | Химия ЕГЭ 2022 | Parta
Parta химия ЕГЭ

Хром и марганец — самые сложные элементы | Химия ЕГЭ 2023 | Parta
Parta химия ЕГЭ
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
15.05.2022
ТРУДНЫЕ ЗАДАНИЯ ЕГЭ ПО ХИМИИ
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ.
К числу таких заданий можно отнести задание
С3 – «Цепочка органических веществ»,
С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углеродакарбоксильной группы будет равна (+3)
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3 + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4 + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3 + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
Галогеналканы
Реакция со спиртовыми растворами щелочей:
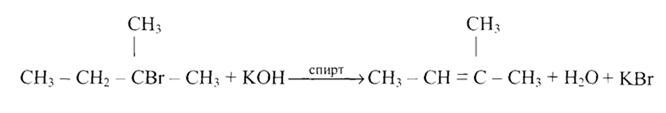
С6Н5-СНВг-СН3 + КОН С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ЗС6Н5СН(ОН)-СН2ОН + MnO2 + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CCH + Ag2O 2CH3-CH2-CCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CCAg + C2H5Br CH3-CH2-CC-C2H5 + AgBr
Бензол и его производные
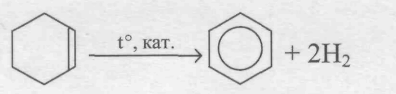
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
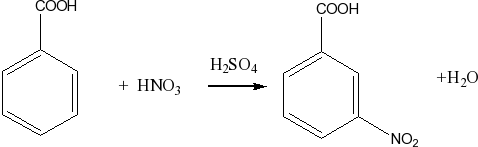
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Строение алкенов. Уместно начинать с него, так как все свойства алкенов тесно связаны с особенностями их строения. У алкенов в составе электронных орбиталей находится одно негибридное облако, которое образует пи-связь с атомом углерода. Для молекул алкенов характерна геометрическая структурная изометрия: из-за того, что P-орбитали перекрываются в двух местах, затруднено вращение относительно углерод-углеродной связи. А если так, значит, есть возможность различного взаиморасположения групп (пример: цис-бутен-2, транс-бутен-2).
Химические свойства алкенов и алканов: сравнение. Наиболее характерный механизм реакции у алканов — радикальный цепной механизм, и реакция начинается с образования свободного радикала. Для алкенов же характерен ионный механизм взаимодействия. Далее, поскольку активная форма молекулы у алкена — двойная углерод-углеродная, то, в отличие от алканов, алкены относятся к ненасыщенным углеводородам и им характерна реакция присоединения. Для алканов характерна реакция замещения. Благодаря высокой химической активности, алкены вступают в реакцию при обычных условиях, а алканам нужны дополнительные факторы — свет, тепло, искра или какой-то другой внешний фактор. И алкены, и алканы реагируют с галогенами (хлор и бром), но для алкенов это реакция присоединения (радикального характера), а для алканов — замещения. Водород присоединяется к алкенам при отсутствии катализатора; алкены могут также присоединять воду и взаимодействовать с кислотами (при этом характер реакций будет ионный). Алканы ни с водой, ни с водородом не реагируют.
Правило Марковникова гласит, что при присоединении протонных кислот или воды к несимметричным алкенам атом водорода будет присоединяться к тому атому углерода, который наиболее гидрогенизирован. Удобно, что все реакции с участием алкинов типовые и запоминаются относительно легко. Научите учеников моделировать реакцию: одни и те же связи разрываются и возникают, например, при взаимодействии алкина с водородом и с бромовой водой.
Из правила Марковникова есть исключения:
1. Когда двойная связь в молекуле алкена соседствует с электронно-акцепторной группой (например, трифторметил). Электронная плотность изменяется, и продукты реакции получаются иные, чем по правилу Марковникова. Атомы фтора сильно электроотрицательны и смещают двойную P-связь.
2. Строго для гидробромирования: взаимодействие несимметричного алкена с бромоводородом при участии органической перекиси. Тогда реакция протекает по радикальному механизму.
3. Сопряженные системы: двойная углерод-углеродная связь сопряжена с двойной углерод-водородной или углерод-азотной связью. Здесь также происходит смещение электронной плотности по P-связи. На атоме углерода возникает избыточный отрицательный заряд, в результате происходит «антимарковниковский» эффект.
Всегда ли для алкенов возможны только реакции присоединения? Согласно теории Бутлерова, достаточно знать строение молекулы, чтобы предсказать свойства вещества. Рассмотрим молекулу алкена пропена. В ней отчетливо выделяются две части: первая от этилена, где атомы углерода в sp2 гибридном состоянии, вторая — от алкана (метана), в которой находится sp3 гибридный атом углерода. Следовательно, пропен сочетает в себе свойства этилена и метана; а для метана характерна реакция замещения под воздействием внешних факторов (например, внешнего облучения). Реакция замещения у пропена возможна благодаря устойчивости аллельного радикала. Для всех алкенов, начиная от пропена, возможны аналогичные реакции, хотя это и не самое характерное свойство данной группы.
Реакция полимеризации. Эта реакция имеет огромное практическое значение, потому что с ее помощью возникает целый ряд углеводородов и их производных — полимеров. Чтобы реакция началась, нужен инициатор — радикал. Он взаимодействует с молекулой, например, этилена; двойная связь в этилене распадается, образовавшаяся частица взаимодействует с другой CH-группой, затем с ещё одной, и так процесс полимеризации идет до тех пор, пока связь не оборвется (это произойдет тогда, когда встретятся два радикала).

Органическая химия в тестовых заданиях. Профильный уровень. 10–11 классы. Учебное пособие
Учебное пособие предназначено для учащихся 10-11 классов общеобразовательных учреждений. Оно окажет помощь в закреплении и углублении знаний по органической химии. В пособии предлагаются задания различной степени сложности, представленные в тестовой форме.
Купить
У учеников часто возникают трудности, когда в задании требуется написать уравнение подобной реакции. Есть простой прием: объемные заместители пишем внизу. Так формула становится нагляднее.
Окисление алкенов. С одной стороны, двойная связь всегда энергетически обязательно сильнее, чем одинарная. С другой стороны, двойная связь — это наиболее активная часть молекулы, поэтому именно двойная связь подвержена окислению. При мягком окислении разрывается двойная связь, образуются двухатомные спирты. Эта реакция проходит в нейтральной среде без нагревания.
Что ещё почитать?
- Демоверсия ЕГЭ-2019 по химии
- Методические подходы к изучению ОВР в основной школе
- Методическая помощь учителю химии
- Изучение сероорганических соединений
- К методике изучения классов неорганических соединений
Если в реакции присутствует серная кислота, происходит жесткое окисление: атом углерода максимально окружает себя атомами кислорода, но одинарные связи по-прежнему не разрушаются. Здесь основная сложность — правильно определить степени окисления и расставить коэффициенты (см. видео).
Получение алкенов. Опорой для изучения этой темы должна быть хорошо усвоенная информация о химических свойствах алканов. Дегидрирование алканов по сути и является процессом получения алкенов. Другой способ — крекинг алканов: при этой реакции всегда образуется два углеводорода, алкен и алкан; интуитивно это ясно, так как на два алкена просто не хватит атомов водорода. Другие способы получения алкенов можно изучить через повторение химических свойств самих алкенов. Например: гидратация алкенов дает спирты, а если от спирта отщепить воду, нагревая его с серной кислотой, получим алкен.
Правило Зайцева. При отщеплении воды от спирта, водород преимущественно отделяется от того атома углерода, у которого водородов меньше (то есть, от вторичного). Примерно та же ситуация наблюдается при дегидрохлорировании, однако, если хлороводород присоединяется к алкену легко, то отщепить его можно только при воздействии щелочи, растворенной в спирте.
Можно присоединить галоген к алкену, получается дигалогеналкан. Отщепить галогены тоже можно, под действием активного двухвалентного металла. Часто у учеников возникает вопрос, можно ли использовать одновалентный металл? Отвечаем: можно, но это нетипичная реакция.
Циклоалканы. Снова начнем со строения. Перед нами цикличные молекулы, изомерные алкенам, не содержащие двойных углерод-углеродных связей. Здесь возможна геометрическая изомерия. Ученикам, сдающим ЕГЭ по химии, полезно знать устойчивые конформации, свойственные тем или иным циклоалканам. Еще запомним правило: малые циклы (трехчлены и четырехчлены) — напряженные, как сжатые пружины, а большие циклы (пяти- и шестичлены) менее напряжены. Для первых характерны реакции присоединения, для вторых — замещения.
Химические свойства циклоалканов. Что могут присоединить малые циклы? Водород, галоген, галогеноводород, при определенных условиях — воду. Большие циклы реагируют примерно так же, как и большие алканы: с бромом, азотной кислотой, возможны реакции дегидрирования.
Получение циклоалканов. Здесь нужно повторить уравнения реакций при взаимодействии дигалогеналканов с активными двухвалентными металлами. Эти уравнения будут очень нужны при выполнении заданий на восстановление цепочки превращений и при решении задач на нахождение формулы вещества.
#ADVERTISING_INSERT#
Вебинар по теме